Методические рекомендации по очистке сыворотки крови крупного рогатого скота, используемой для культивирования клеточных культур
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Оглавление
Предисловие
1. Описание метода очистки сыворотки
2. Определение качества сыворотки после обработки полиэтиленгликолем
Предметный указатель
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.02.2020 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.220 Ветеринария
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
| 07.07.1982 | Утвержден | Главное управление карантинных инфекций Министерства здравоохранения СССР | |
|---|---|---|---|
| 17.07.1982 | Утвержден | Главное управление ветеринарии Минсельхоза СССР | |
| Издан | Агропромиздат | 1986 г. |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13
стр. 14
стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23
СПВ4ВОЧНИК
ЛАБСШОРНЬЕ
ИССЛЕДОВАНИЯ В ВЕТШ/1НАРИИ
БАКТЕИ^АЛЬНЫЕ
ИНТЕКЦИИ
СПРАВОЧНИК
ЛАБОРАТОРНЫЕ
ИССЛЕДОВАНИЯ
В ВЕТЕРИНАРИИ
•
БАКТЕРИАЛЬНЫЕ
ИНФЕКЦИИ
Под редакцией Б. И. АНТОНОВА
МОСКВА АГРОПРОМИЗДАТ 1986
определения индекса пролиферации диплоидные клетки снимают со стекла 0,25%-ным раствором трипсина, а фибробласты куриных эмбрионов — 0,02%-ным раствором версена или смесью растворов версена и трипсина в соотношении 1:1. Снятые клетки тщательно пнпетируют в определенном объеме среды. Из полученной суспензии отбирают 1 мл, добавляют 1 мл 0,1%-ного раствора кристалл виол ета, приготовленного на 0,1 М растворе лимонной кислоты, и подсчитывают окрашенные клетки в камере Горяева.
2.4.3. Для подсчета клеток пользуются следующей формулой: Х=аХ2Х 111IX#, где X — общее количество выросших клеток; а — количество клеток в камере; В — объем суспензии, мл; 2 — степень разведения; 1111 — коэффициент пересчета.
Индекс пролиферации (ИП)=Х : У, где У — общее количество засеянных клеток, которое равно посевной дозе, т. е. количеству клеток в 1 мл среды на объем вносимой суспензии.
2.5. Контроль сывороток крупного рогатого скота на наличие специфических антител.
2.5.1. Специфические антитела в сыворотке крупного рогатого скота к наиболее распространенным вирусным болезням определяют согласно «Методическим указаниям по лабораторной диагностике вирусных респираторных инфекций крупного рогатого скота» (рекомендованы Главным управлением ветеринарии Минсельхоза СССР 25 июля 1978 г.).
2.5.2. Для выявления антител используются следующие серологические реакции.
Инфекция Реакции
Инфекционный ринотрахеит.....PH, РДП, РИГА
Парагрипп-3............РТГА
Вирусная диарея..........PH, РСК
Аденовирусная инфекция......РИГА, РСК
Респираторно-синцитиальная инфекция РДП, РИГА Грипп...............РТГА, РСК
2.5.3. При постановке серологических реакций используют соответствующие каждой инфекции диагностические наборы, выпускаемые биологической промышленностью.
2.5.4. Пробы сывороток перед исследованием прогревают при температуре 56°С в течение 30 мин. Для удаления термостабильных неспецифических ингибиторов перед постановкой РТГА используют один из следующих методов.
Обработка сыворотки перйодатом калия (для вирусов гриппа). Перед началом исследований в 25 мл дистиллированной воды растворяют при комнатной температуре 0,064 г KJ04. 3 части раствора KJ04 смешивают с 1 частью сыворотки и выдерживают 15 мин при комнатной температуре. После этого добавляют 3 части 1%-ного глицерина (раствор готовят на физиологическом растворе) и 1 часть физиологического раствора, так что сыворотка становится разведенной 1:8.
Обработка сыворотки с помощью С0г (применяется для вирусов гриппа). Сыворотку разводят в дистиллированной воде в соотношении 1 : 10 и добавляют к ней кусочек сухого льда или пропускают углекислый газ, который получают в аппарате Киппа с помощью реакции между бикарбонатом кальция и разбавленной соляной кислотой. Через 5— 10 мин выпадает беловатый осадок, который удаляют центрифугированием.
Обработка сыворотки каолином (применяется для вируса парагриппа и аденовирусов). При постоянном перемешивании к 100 мл боратно-солевого раствора с pH 9,0 добавляют 25 г каолина. 1 часть сыворотки, разведенной в соотношении 1 : 5 боратно-солевым раствором, встряхивают вместе с 1 частью 15%-ной суспензии каолина в течение 20 мин при комнатной температуре, затем смесь центрифугируют 30 мин при 3000 об/мин и надосадочную жидкость используют как сыворотку в разведении 1 : 10.
2.5.5. Постановка реакции нейтрализации с целью выявления антител к вирусу инфекционного ринотрахеита и вирусной диареи. PH проводят методом разведения испытуемых сывороток с постоянной дозой вируса. Для этого необходимо предварительно титровать вирус в культуре клеток. Сухой антиген (вирус) разводят десятикратно от 10“* до 10“10 (конечный титр сухого антигена указан на этикетке) питательной средой. Каждым разведением в объеме 1 мл заражают по 4 пробирки с культурой клеток (ПЭК — почка эмбриона коровы или ТБ — тексти-кулы бычка), отмытой раствором Хенкса. Культуры клеток инкубируют при 37°С, ежедневно просматривают и учитывают результаты на 5— 7-е сут.
Титром вируса считают наибольшее разведение его, вызывающее ЦПД в 50% культур клеток. Вычисляют титр по методу Рида и Менча и выражают в ТЦД50/мл.
Готовят двукратные разведения сыворотки от 1 : 2 на питательной среде в объеме 0,5 мл. Для этого в стерильные пробирки вносят 0,5 мл испытуемой сыворотки, тщательно перемешивают, переносят во вторую и т. д. Затем готовят необходимый объем вируса, содержащего J00 или 1000 ТЦД50 в 0,1 мл, и добавляют равный объем его (0,5 мл) в каждую пробирку с разведением сыворотки. Смесь сыворотки и вируса встряхивают, выдерживают при 37°С в течение 1 ч для вируса ИРТ; при 4°С в течение 2—3 ч для ВД. После этого в 4 пробирки с культурой клеток вносят по 0,2 мл смеси сыворотки и вируса и по 0,8 мл поддерживающей среды. Культуры клеток инкубируют при 37°С. Реакцию учитывают после выявления цитопатических изменений в культуре клеток.
Для контроля оставляют 4 пробирки с незараженной культурой клеток, 4 пробирки заражают по 0,2 мл вируса в рабочей дозе.
Титром сыворотки считают ее предельное разведение, сдерживающее развитие ЦПД вируса в 50% зараженных культур клеток.
2.5.6. Постановка реакции непрямой гемагглютинации (РИГА) с целью выявления антител к вирусу инфекционного ринотрахеита, адено- и PC-инфекции. Исследуемые и контрольные (специфическую и отрицательную) сыворотки разводят двукратно в объеме 0,2 мл'. К каждому разведению добавляют по 0,05 мл (одной капле) эритроцитарного диагности кума.
Разведение сывороток готовят на физиологическом растворе pH 7,2—7,4, содержащем 1% нормальной сыворотки кролика, истощенной эритроцитами барана, или 0,02% бычьего альбумина. Смесь сыворотки с антигеном осторожно встряхивают и оставляют на 1—2 ч при комнатной температуре. Реакцию можно ставить микрометодом.
За титр антител принимают наибольшее разведение сыворотки, которое вызвало агглютинацию эритроцитарного диагностикума (антигена). В ряду с контрольной отрицательной сывороткой агглютинации не должно быть.
2.5.7. Постановка реакции торможения гемагглютинации (РТГА) для выявления антител к вирусу парагриппа-З и гриппу. Реакцию про-
водят в панелях с лунками из оргстекла в объеме 0,45 мл или микрометодом.
Вначале титруют антиген (вирус) в РГА и определяют его рабочее разведение. Для этого вирус разводят в объеме 0,2 мл на физиологическом растворе от 1 : 2 до 1 : 256. Затем во все лунки вносят по 0,05 мл (по одной капле) 5%-ной взвеси эритроцитов морской свинки (парагрипп-3) или петуха (грипп). Для контроля на спонтанную агглютинацию смешивают в нескольких лунках по 0,05 мл взвеси эритроцитов с 0,2 мл физиологического раствора. Для перемешивания компонентов панели встряхивают и оставляют при комнатной температуре на 60— 90 мин до полного оседания эритроцитов в контрольных лунках, после чего их просматривают на освещенном белом фоне.
Положительная РГА оценивается по форме осадка эритроцитов, которые осаждаются на стенках, образуя зонтик.
Титром вируса считается наибольшее разведение его, при котором наблюдается агглютинация эритроцитов, что соответствует одной гем-агглютинирующей единице (ГАЕ) в 0,2 мл. Рабочее разведение должно содержать в 0,2 мл 4 ГАЕ. Поэтому показатель последнего разведения антигена, вызвавшего агглютинацию, делят на 4. Например, если агглютинирующий титр равен 1 : 128, то рабочее разведение (4 ГАЕ в 0,2 мл) будет 1 : 32.
Рабочую дозу антигена контролируют в РГА. Для этого в 4 лунки наливают по 0,2 мл физиологического раствора. В первую лунку вносят 0,2 мл рабочего разведения вируса, смешивают и переносят в последующие лунки. Из четвертой лупки 0,2 мл удаляют. Во все лунки добавляют по 0,2 мл физиологического раствора и по 0,05 мл взвеси эритроцитов. Реакцию учитывают через 60—90 мин. При правильном выборе рабочего разведения вируса в первой и второй лунках, содержащих соответственно 2 и 1 ГАЕ, должна быть полная агглютинация, а в третьей и четвертой лунках агглютинации не должно быть.
Для постановки основного опыта в одном ряду готовят в объеме 0,2 мл двукратные разведения специфической сыворотки до указанного на этикетке ампулы титра. Во втором ряду разводят отрицательную сыворотку. В каждую лунку рядов вносят по 0,2 мл рабочего разведения вируса, содержащего 4 ГАЕ. В третьем ряду ставят контроль эритроцитов (0,05 мл эритроцитов и 0,4 мл физиологического раствора). Панели встряхивают и после 60—90-минутного контакта сыворотки с вирусом в каждую лунку добавляют по 0,05 мл 5%-ной взвеси эритроцитов.
Реакцию учитывают через 60—90 мин после оседания эритроцитов в контрольных лунках третьего ряда.
2.5.8. Постановка реакции диффузионной преципитации в геле.
Компоненты реакций:
специфическая лреципитирующая сыворотка;
контрольная отрицательная сыворотка;
специфический антиген;
исследуемая сыворотка.
Агаровую среду готовят по прописи: агар — 1,0; физиологический раствор pH 7,4—100,0 мл. Агар расплавляют в водяной бане и разливают в чашки Петри по 25 мл или на обезжиренные предметные стекла. В слое застывшего агара при помощи штампа нарезают лунки —одну центральную и 6 вокруг нее па расстоянии 0,5—0,7 см.
Постановка реакции. В центральную лунку вносят специфический антиген, в лунки по окружности — сыворотки. Чашки Петри или предметные стекла помещают во влажную камеру, выдерживают при
37°С в течение 18—24 ч и затем при комнатной температуре в течение такого же времени.
Учет реакции. Реакцию считают положительной при условии образования ясно выраженной линии преципитации между лунками со специфическим антигеном и исследуемой сывороткой, а также между специфическим антигеном и контрольной положительной сывороткой при отрицательном результате с отрицательной сывороткой.
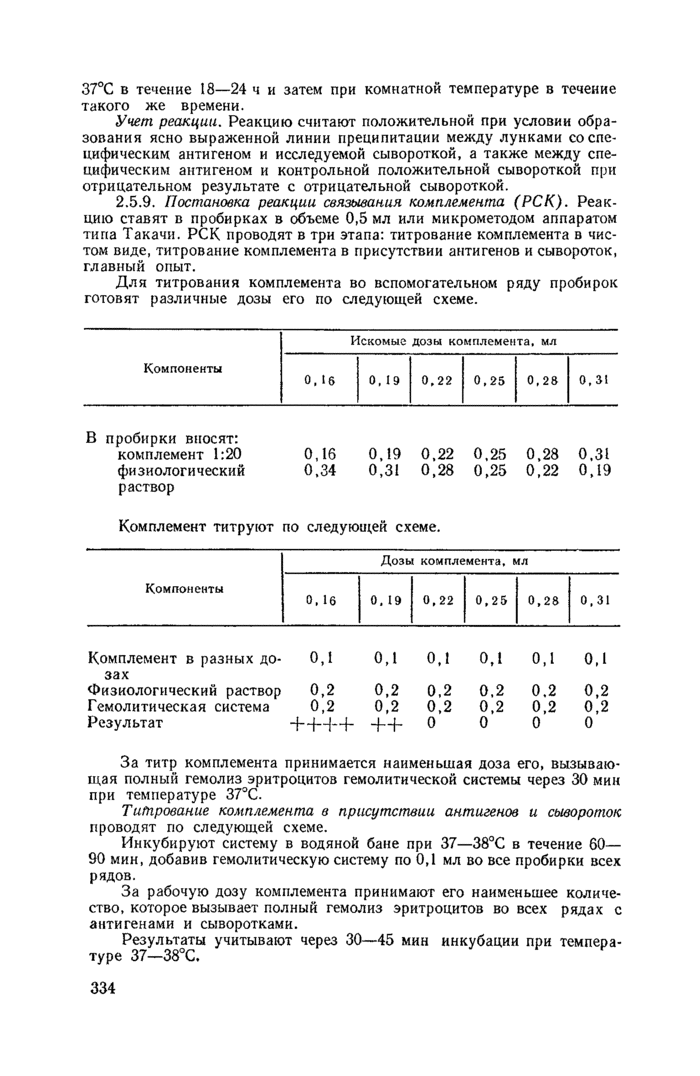
2.5.9. Постановка реакции связывания комплемента (РСК). Реакцию ставят в пробирках в объеме 0,5 мл или микрометодом аппаратом типа Такачн. РСК проводят в три этапа: титрование комплемента в чистом виде, титрование комплемента в присутствии антигенов и сывороток, главный опыт.
Для титрования комплемента во вспомогательном ряду пробирок готовят различные дозы его по следующей схеме.
| ||||||||||||||||||||||||||||
|
раствор | ||||||||||||||||||||||||||||
|
Комплемент титруют по следующей схеме. | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
За титр комплемента принимается наименьшая доза его, вызывающая полный гемолиз эритроцитов гемолитической системы через 30 мин при температуре 37°С.
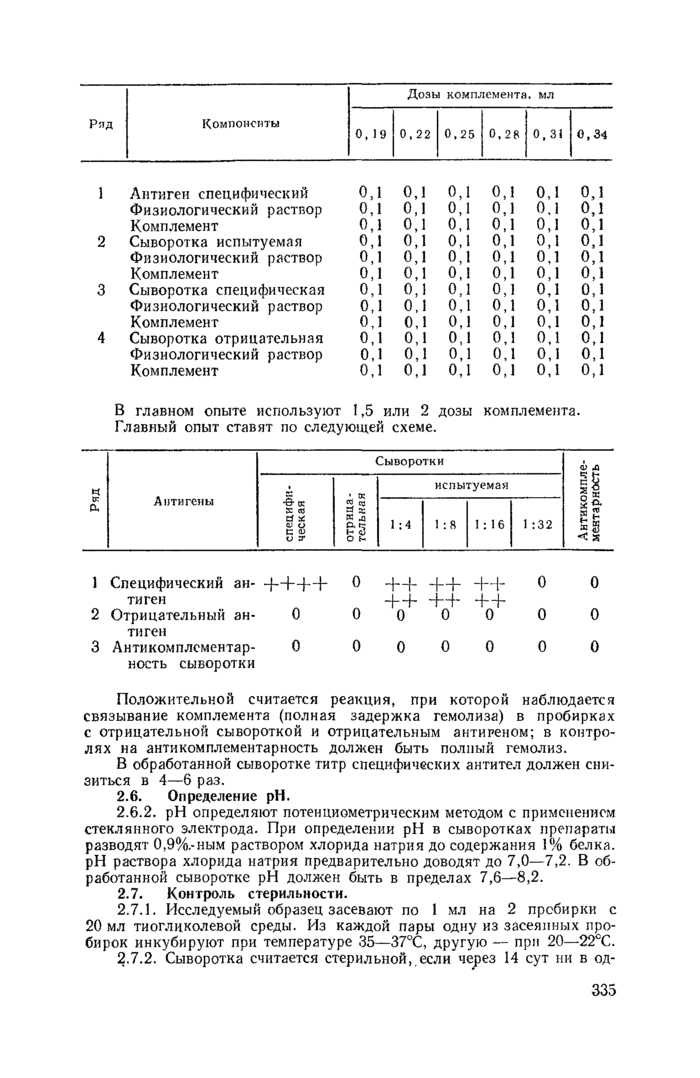
Титрование комплемента в присутствии антигенов и сывороток проводят по следующей схеме.
Инкубируют систему в водяной бане при 37—38°С в течение 60— 90 мин, добавив гемолитическую систему по 0,1 мл во все пробирки всех рядов.
За рабочую дозу комплемента принимают его наименьшее количество, которое вызывает полный гемолиз эритроцитов во всех рядах с антигенами и сыворотками.
Результаты учитывают через 30—45 мин инкубации при температуре 37—38°С.
1 Антиген специфический Физиологический раствор Комплемент 2 Сыворотка испытуемая Физиологический раствор Комплемент 3 Сыворотка специфическая Физиологический раствор Комплемент 4 Сыворотка отрицательная Физиологический раствор Комплемент |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
В главном опыте используют 1,5 или 2 дозы комплемента. Главный опыт ставят по следующей схеме.
|
Сыворотки |
Ф л | |||||||
|
и |
Антигены |
испытуемая |
|§ й * | |||||
|
(X |
специф ческая |
« BJ 2 * 5 л а. гг н «3 о |
1:4 |
1 :Я |
1:16 |
1:3 2 |
it Is < я | |
|
1 |
Специфический антиген |
++++ |
0 |
"1—Ь ++ |
+-ь |
++ +4* |
0 |
0 |
|
2 |
Отрицательный антиген |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
3 |
Антикомплсментар-ность сыворотки |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
Положительной считается реакция, при которой наблюдается связывание комплемента (полная задержка гемолиза) в пробирках с отрицательной сывороткой и отрицательным антигеном; в контро-лях на антнкомплсментарность должен быть полный гемолиз.
В обработанной сыворотке титр специфических антител должен снизиться в 4—6 раз.
2.6. Определение pH.
2.6.2. pH определяют потенциометрическим методом с применением стеклянного электрода. При определении pH в сыворотках препараты разводят 0,9%.-ным раствором хлорида натрия до содержания 1% белка. pH раствора хлорида натрия предварительно доводят до 7,0—7,2. В обработанной сыворотке pH должен быть в пределах 7,6—8,2.
2.7. Контроль стерильности.
2.7.1. Исследуемый образец засевают по 1 мл на 2 пробирки с 20 мл тиогликолевой среды. Из каждой пары одну из засеянных пробирок инкубируют при температуре 35—37°С, другую — при 20—22°С.
2.7.2. Сыворотка считается стерильной,.если через 14 сут ни в од-
ной из засеянных пробирок не наблюдается роста. В случае роста хотя бы в одной из засеянных пробирок контроль стерильности повторяют на том же количестве образцов. При отсутствии роста при повторном контроле препарат считают стерильным. При наличии роста при повторном контроле хотя бы в одной из пробирок и идентичности микрофлоры при первичном и повторном посевах сыворотку бракуют как нестерильную. Если при первичном и повторном посевах выявлена различная микрофлора, допускается посев образцов в третий раз. При отсутствии роста препарат признают стерильным. Если в этом случае обнаруживается рост хотя бы в одной пробирке, независимо от характера микрофлоры препарат признают нестерильным и бракуют.
2.8. Контроль контаминации вирусами.
2.8.2. Контаминацию сыворотки вирусами контролируют па пер-вично-трнпсинизированных культурах клеток почек и тестикул эмбрионов коров. Почки н тестикулы эмбриона коровы извлекают асептически. Для получения первичных культур клеток соответствующие органы тщательно промывают в растворе Хенкса, освобождают от капсул, измельчают ножницами на кусочки размером 5—7 мм, промывают 2— 3 раза 0,5%-ным раствором гидролизата лактальбумина с антибиотиками (по 100 ЕД/мл пенициллина и стрептомицина). Ткань заливают 0,25%-ным раствором трипсина; трипсипизацию ведут при комнатной температуре с постоянным перемешиванием материала магнитной мешалкой. Производят 4—5 экстракций в течение 11/2 ч. Клеточную суспензию собирают, разводят раствором Хенкса 1:1. Зат^м клетки осаждают центрифугированием при 1000 об/мин 10 мин и ресуспендируют в питательной среде. В качестве питательной среды применяют 0,5%-ный раствор гидролизата лактальбумина с 10% сыворотки крупного рогатого скота, предварительно проверенной на отсутствие вирусов-контами-нантов. Концентрация почечных клеток в 1мл среды — 400 тыс., тестикулярных — 550 тыс. Слой формируется на 4—5-е сут. Контроль сыворотки ставят на литровых матрасах. Образовавшийся сплошной монослой перед взятием в опыт промывают 3 раза питательной средой без сыворотки. Испытуемую сыворотку инокулируют в матрас в объеме 25 мл так, чтобы разведение в среде не превышало 1 : 4 и из расчета не менее Зсм2 площади на I мл сыворотки. Контакт контролируемой сыворотки с культурой клеток — 1 ч при комнатной температуре. Затем сыворотку сливают и клетки заливают поддерживающей средой (среда с 0,5% гидролизата лактальбумина). Не менее 10% клеток оставляют в качестве контроля и проводят с ними те же манипуляции, что и с опытными культурами, добавляя ранее отконтролированную сыворотку. Культуры инкубируют при 37°С в течение 14 дн. с еженедельной частичной (а/з объема) сменой среды. Микроскопируют культуру на 1, 5, 7 и 14-е сут. По истечении времени наблюдения однократно замораживают все матрасы в сухом льду и затем оттаивают их. Полученный материал без центрифугирования после энергичного встряхивания вносят в матрасы с культурой клеток того же вида ткани в объеме 25 мл. Культуры пассажиру ют также в течение 14 дн.
2.8.3. По окончании контроля на цитопатогениые вирусы культуры проверяют на наличие гемадсорбпрующих вирусов. Для этого в матрасы с культурами клеток добавляют 0,25%-ную взвесь смешанных в одинаковом соотношении куриных эритроцитов и эритроцитов морских свинок. Взвесь эритроцитов вносят во флаконы в количестве, достаточном для покрытия монослоя клеток. После 30-минутного контакта при 37°С эритроциты удаляют, монослой промывают раствором Хенкса и просматривают под микроскопом.
33G
2.8.4. Если при первичной инокуляции сыворотки и в пассаже не выявлено признаков дегенерации культур клеток и не отмечено гемад-сорбции, сыворотка признается годной.
Если при исследовании возникли дегенеративные изменения или отмечена гемадсорбция в испытуемых культурах клеток при ее отсутствии в контрольных флаконах, сыворотку бракуют.
Если дегенеративное изменение или гемадсорбция появились в контрольных и опытных культурах клеток, допускается однократный повторный контроль сыворотки.
2.9. Контроль контаминации микоплазмами.
2.9.1. Исследуемый материал сеют на среду с 0,3%-ным агаром, основа которой —триптический перевар сердечной мышцы крупного рогатого скота с добавлением 10% дрожжевого экстракта, 10% нормальной лошадиной сыворотки (без консерванта) и 100 ЕД/мл пенициллина.
Методика посева. Среду с 0,3% агара разогревают в водяной бане до полного растворения агара, охлаждают до 40—45°С, тут же добавляют лошадиную сыворотку и пенициллин и разливают по 10 мл в бактериологические пробирки, в которые затем вносят 1 мл исследуемой сыворотки. Посев — столбиком (от дна пробирки) на 10 пробирок. Пробирки инкубируют при 37°С в течение 14 дн. Просматривают на 3, 5, 7 и 14-е сут. При наличии в первичном посеве опалесценции, слабого помутнения среды проводят 3 «слепых» пассажа на среде с 0,3% агара по описанной выше методике. При наличии роста высевают из зоны роста на чашки Петри с 1,3%-ным агаром (той же прописи, что и исходная среда) в количестве 0,1—0,2 мл посевного материала на чашку, инкубируют 7—10 дн. при 37°С с ежедневным просмотром для обнаружения колоний микоплазм (под малым увеличением микроскопа: ок. 7, об. 10).
При обнаружении типичных колоний микоплазм сыворотку бракуют.
Состав среды на триптическом переваре бычьего сердца:
гидролизат бычьего сердца — 200 мл;
мясная вода 1:2 — 400 мл;
дрожжевой экстракт 50%-ный — 100 мл;
хлористый натрий — 5 г;
дистиллированная вода — 300 мл.
Если готовится полужидкий 0,3%-ный агар, то к 1 л среды добавляется 3 г агар-агара. Если же готовится 1,3%-ный полутвердый агар, то на 1 л среды берется 13 г агар-агара. Окончательный pH — 7,6—7,8, стерилизация при 110°С 30 мин.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
е
|
Агар глюкозо-кровяной 227 — дрожжевой 27 — картофельный 82 — кровяной 230 — молочно-солевой 228 — мясо-пептонный печеночно* глюкозо - глицериновый (МППГГА) 82 — печеночно-аминопептидный 85 — печен очно-глюкозо-глицериновый (ГИТА) 82 — плотный печеночно-сывороточный 85 — полужидкий печеночно-сывороточный 85 — полужидкий с дефибриниро-ванной кровью 248 — сывороточно-декстрозный 85 — шоколадный 239 Бульон глюкозо-сывороточный 227 — дрожжевой 27 — мясо-пептон ный печеночный (МППБ) 82 — печен оч но-глюк озо-глицериновый 82 — с желчью 10%-ный 186, 227 — 40%-ный 230 Вода мясная 82 — печеночная 82 Выбор питательных сред 271 Гель агаровый 1%-ный 31 Дезагрегация ткани 314 Жидкость Карнуа 309 Индикатор для определения анаэробных условий 39 Консервирующая смесь глицериновая 185 --фосфатная буферная 185 Лизис желчью 225 |
Метод выявления капсулообра-зования 13, 14 — определения вирулентности сибиреязвенных культур 14 — флуоресцирующих антител (МФА) 180 Молоко с метиленовым синим 228 — с 0,02%-ньм метиленовым синим 230 Обнаружение индола 217 Окраска мазков гематоксилин-эозином 309 --по Козловскому 81 --по методу Гипса 239 --по Романовскому — Гим- зе 309 --по Стампу 81 --по Фельгену 309 --по Шуляку — Шину 82 Определение гемолитической активности 8 — концентрации углекислого газа 85 Получение и подготовка эритроцитов барана для постановки РСК и РДСК 86 Приготовление индикаторных бумажек 187 Раствор антибиотиков 272 — веронал-мединаловый буферный 329 — версена 282 — гидролизата лактоальбумииа 0,5%-ный 283 — гидролизата мышечных белков 0,3%-ный 282 — глицерина 216 — двууглекислого натрия 282 — двухромовокислого калия 279 — полиэтиленгликоля 326 — Тироде 281 — трипсина 283 — уксусной кислоты 282 |
|
— физиологический хлорида натрия с добавлением ионов магния и кальция (для постановки РСК и РДСК) 86 — Хенкса 281 — хлориду натрия феиолезиро-ванные для.РА 86 Реактив биуретовый 328 — йодистый калий 328 Реакция диффузной преципитации в геле 333 — с метилротом 218 — нейтрализации с целью выявления антител к вирусу инфекционного ринотрахеита и вирусной диареи 332 — непрямой гемагглютинации (РПГА) 332 — преципитации 8 — связывания комплемента (РСК) 334 — торможения гемагглютина-ции (РТГА) 332 — Фогеса — Проскауэра 218 — Эрлиха 181 — метиленового синего 226 Среда Биттера с рамнозой 187 — водно-сывороточная 145 — дифференциальная висмут-сульфат-агар 186 -- Левина 186 --Плоски рева 186 --трехуглеводная с мочевиной 186 --Эндо 186 — для обнаружения сероводорода 216 — для определения способности бактерий расщеплять мочевину 218 н — для посева по Свену — Гарду 187 — Дюбуа — Смита 90 — Заксе 243 — Игла 282, 324 |
— из гидролизата мышцы сердца крупного рогатого скота 252 — из куриного мяса 260 — Кларка 218 — Клиглера 217 — комбинированная Олькениц-кого 216 — Мартена 251, 260 — плотная ВИЭВ для изоляции кампилобактерий 125, 126 — сафранино-железо-новобиоци-новая 123, 124 — Симмонса 216 — с лактозой 252 — с повышенным содержанием лактозы 187 — с теллуритом калия 228 — триптический перевар бычьего сердца 337 — Ферворта — Вольфа в модификации С. И. Тарасова 146 — Флетчера 146 — 6,5%-ного хлорида натрия 228 — Хоттингера 259 — Эдварда 258 — энтерококковая дифференциально-диагностическая 228 Среды индикаторные с амидочерным 168 --с конгоротом 168 --с лакмусом 167 --с метил ротом 167 --с нейтральротом и метиленовой синью 167 --обогащения Кауфмана 186 --Киллиана 186 --Мюллера 186 -- селенитовая 185 — плотные питательные 252 Тест «жемчужного ожерелья» 6,7 Фаготипирование 17—28 Экстракт дрожжевой 252 Эритрит-агар 85 |
СОДЕРЖАНИЕ
©
Предисловие........................ 3
Методы диагностики бактериальных инфекций....... 5
Сибирская язва.................... 5
Методические указания по лабораторной диагностике сибирской язвы ..................... 5
Методические указания по обнаружению возбудителя сибирской язвы в сырье животного происхождения и объектах
внешней среды..................... 9
Временное наставление по применению сибиреязвенного бактериофага «К» ВИЭВ для определения возбудителя сибирской язвы..................... 17
Временное наставление по применению сибиреязвенного фага «Гамма-MBA» для определения возбудителя сибирской
язвы.......................... 28
Временные методические указания по постановке реакции диск-преципитации при диагностике сибирской язвы и идентификации ее возбудителя................ 29
Наставление по исследованию кожевенного и мехового сырья
на сибирскую язву реакцией преципитации ....... 31
Эмфизематозный карбункул................. 37
Методические указания по лабораторной диагностике эмфизематозного карбункула................. 37
Злокачественный отек.................... 40
Методические указания по лабораторным исследованиям
на злокачественный отек животных.......... 40
Брадзот овец........................ 44
Методические указания по лабораторной диагностике брад-
зота овец....................... 44
Инфекционная энтеротоксемия животных и анаэробная дизентерия ягнят......................... 48
Методические указания по лабораторной диагностике инфекционной энтеротоксемии животных и анаэробной дизентерии ягнят....................... 48
Столбняк.......................... 52
Методические указания по лабораторной диагностике столбняка .......................... 52
Ботулизм.......................... 53
Методические указания по лабораторной диагностике ботулизма .......................... 53
Некробактериоз ....................... 56
Методические указания по лабораторной диагностике некро-
бактериоза....................... 56
Копытная гниль овец и коз................ 58
Приложение к «Инструкции по профилактике и ликвидации копытной гнили овец и коз» .............. 58
ББК 48.73 Л 12
УДК 619:616.9—08(031)
Составители: Б. И. Антонов, В. В. Борисова, Я. М. Волкова, »/7. Я. Каменева, Л. В. Кошеленко, Г. А. Михальский, В. В. Лоповцев, Л. И. Прянишникова, В. Е. Храпова
Лабораторные исследования в ветеринарии. Бакте-Л12 риальные инфекции: Справочник/Сост. Б. И. Антонов, В. В. Борисова, П. М. Волкова и др.; Под ред. Б. И. Антонова.— М.: Агропромиздат, 1986.— 352 с.
В книге даны методы лабораторных исследований патологического материала с целью определения возбудителя нпфекционноЛ болезни. Они изложены по единой схеме: бактериологические и бактериоскопнческие исследования, биопроба, идентификация и дифференциация возбудителей. Методы унифицированы и стандартизированы
Для ветврачей и фельдшеров, лаборантов ветеринарных лабораторий.
3805020000-079 035 (01)-86
305—86
ББК 48.73
© ВО «Агропромиздат», 1986
Временные методические указания по обнаружению возбудителя копытной гнили в патологическом материале от больных овец с помощью непрямого метода иммунофлуоресценции .......................... 59
Бруцеллез......................... 60
Наставление по диагностике бруцеллеза животных ... 60
Паратуберкулез ...................... 89
Наставление по диагностике паратуберкулезного энтерита
(паратуберкулеза) крупного рогатого скота ....... 89
Методика обнаружения в патологическом материале возбудителей туберкулеза и паратуберкулеза методом люминесцентной микроскопии.................. 92
Временное наставление по' постановке реакции связывания комплемента для диагностики паратуберкулеза крупного рогатого скота и овец с антигеном Сибирского научно-исследовательского ветеринарного института ........ 94
Сап............................ 104
Методические указания по лабораторной диагностике сапа 104
Кампилобактериоз (вибриоз)................ 112
Извлечение из временной инструкции по диагностике, профилактике и ликвидации вибриоза крупного рогатого скота и овец........................ 112
Наставление по применению кампилобактериозных (вибриозных) люминесцирующих сывороток при лабораторной диагностике кампилобактериоза (вибриоза) животных .... 120
Рекомендации Центральной ветеринарной лаборатории по приготовлению и применению сафранино-жел зо-новобиоци-
Наставление по применению вибриозных агглютинирующих моноспецифических сывороток.............. 116
новой среды (СЖН) при лабораторной диагностике вибриоза 123 Временные рекомендации Центральной ветеринарной лаборатории по приготовлению и применению плотной среды ВИЭВ
для изоляции кампилобактерий............. 125
Наставление по применению кампилобактериозного (вибри-озного) антигена для реакции агглютинации с вагинальной
слизью (РАВС).................... 126
Лептоспироз......................... 128
Методические указания по лабораторной диагностике леп-
тоспнроза животных.................. 128
Методические указания по применению групповых агглютинирующих лептоспирозных сывороток.......... 146
Методические указания по применению флуоресцирующего
глобулина для диагностики лептоспироза ....... 148
Листериоз......................... 151
Наставление по лабораторной диагностике листериоза животных ......................... 151
Методические указания по применению набора лиофилизи-рованных бактериофагов для идентификации возбудителя
листериоза....... 169
Рожа свиней........................ 170
Методические указания по лабораторным исследованиям на
рожу свиней...................... 170
Наставление по применению сухих рожистых люминесцирующих сывороток (для прямого метода иммунофлуоресценции) .......................... 173
ПРЕДИСЛОВИЕ
В деле выполнения решении партии и правительства по дальнейшему развитию животноводства, а также задач, поставленных Продовольственной программой страны, ветеринарной службе большую помощь оказывают ветеринарные лаборатории.
Ветеринарные лаборатории осуществляют диагностику инфекционных и паразитарных болезней животных, выявляют нарушения обмена веществ в их организме, проводят исследования, направленные на предупреждение отравлений, помогая тем самым специалистам совхозов, колхозов и других хозяйств успешно осуществлять лечебнопрофилактические мероприятия. От того, насколько своевременно ставится диагноз, разработаны и рекомендованы профилактические и лечебные меры, зависит успех ликвидации болезней, сохранность поголовья животных и повышение их продуктивности.
Последнее время в лабораториях появилось много приборов и приспособлений, облегчающих труд специалистов и позволяющих проводить исследования на более современном и качественном уровне, с большой достоверностью. В связи с этим многие ранее действовавшие методические указания переработаны.
Кроме того, ежегодно для лабораторной практики предлагаются новые методы диагностики. В отечественной и зарубежной литературе постоянно публикуется большое количество материалов о новых методах исследований, предлагаются различные модификации существующих методик, вводятся дополнительные диагностические тесты.
Ветеринарные лаборатории в своей работе не могут использовать всего многообразия имеющихся в литературе методов исследования или из-за того, что они недостаточно апробированы, или из-за сложности применяемого оборудования. Иногда методы, предлагаемые различными авторами, при определении одних и тех же показателей дают несовпадающие результаты.
В связи с этим в справочник включены методы лабораторных исследований патологического материала, получаемого от больных, убитых или павших сельскохозяйственных животных, апробированные Центральной ветеринарной лабораторией и утвержденные Главным управлением ветеринарии Министерства сельского хозяйства СССР. Книга содержит методические указания по диагностике инфекционных болезней бактериальной этиологии, а также методические указания по применению культур клеток в диагностических исследованиях.
Методики изложены по единой схеме,- взятие и пересылка патологического материала, методы его обработки и обогащения; бактериоско-пические исследования, включая световую и люминесцентную микроскопию; выделение культур возбудителей инфекционных болезней на питательных средах; заражение лабораторных животных как с целью выделения чистой культуры возбудителя, так и определения степени ее патогенности; гистологические исследования; идентификация и дифференциация возбудителей с использованием различных методов; серологические исследования для определения вида возбудителя.
Приведенные в справочнике методы лабораторных исследований унифицированы и стандартизированы. В широком смысле слова унификация и стандартизация подразумевают применение для различных исследований одних и тех же аппаратов, приборов, инструментов, посуды, реактивов, исключая, конечно, специальные методы исследования; применение стандартных (унифицированных) питательных сред и диагностикумов; разработку методических указаний по единой форме. Все это позволяет лабораторным работникам с меньшей затратой сил и средств, на высоком методическом и техническом уровне, качественно и в срок проводить диагностические исследования. Таким образом, стандартизация методов исследования явится способом наведения строгого порядка в работе ветеринарных лабораторий.
Книга предназначена для ветеринарных врачей, фельдшеров, а также лаборантов ветеринарных диагностических лабораторий.
В справочник не вошли материалы по диагностике туберкулеза, так как они пересматриваются и дополняются, поэтому их публикация будет осуществлена в последующих изданиях.
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ОЧИСТКЕ СЫВОРОТКИ КРОВИ КРУПНОГО РОГАТОГО СКОТА, ИСПОЛЬЗУЕМОЙ ДЛЯ КУЛЬТИВИРОВАНИЯ КЛЕТОЧНЫХ КУЛЬТУР
(Утверждены Главным управлением ветеринарии Минсельхоза СССР 17 июля 1982 г.,
Главным управлением карантинных инфекций Министерства здравоохранения СССР 7 июля 1982 г.)
Сыворотка крупного рогатого скота (КРС) широко применяется при культивировании органов и тканей, используемых при диагностике и изготовлении вакцин против ряда вирусных болезней человека и животных, а также в молекулярной биологии, клеточной иммунологии. В ближайшей перспективе этот препарат в СССР будет оставаться основным сывороточным компонентом вирусологических питательных сред. При существующих технологических методах получения сыворотки не очищаются от гамма-глобул и новой фракции белков. Необходимость в такого рода очистке вызывается тем, что сыворотка содержит в больших количествах антитела в гамма-глобул и новой фракции белков, которая может оказать существенное влияние на ход вирусологических исследований и на накопление вирусов при производстве вакцин. Накопление в сыворотках антител происходит в основном в результате переболева-ния скота рядом Полезней, и в первую очередь такими, как грипп, пара-грипп, инфекционный ринотрахеит и др.
Кроме того, сыворотка крови животных, и в особенности крупного рогатого скота, может быть коптами ни рован а вирусами и микоплазмами, которые могут в ней оставаться и после стерилизующей фильтрации.
Известны способы фракционирования белков сыворотки крови полиэтиленгликолем (ПЭГ) и выделения из нее инфекционных агентов. При этом ПЭГ используется в комбинации с сульфатом аммония, спиртом, ультрацентрифугированием. Однако обработанные такими способами сыворотки непригодны для культивирования клеточных культур, так как лишены факторов, стимулирующих прикрепление, рост и размножение клеток.
Введение в действие настоящих рекомендаций позволит совершенствовать работу по очистке сыворотки крови КРС от гамма-глобулино-вой фракции белков, а также от вирусов и микоплазм при сохранении ее ростостимулирующих свойств и тем самым откроет более широкие возможности для ее использования при культивировании тканевых культур и репродукции на них вирусов. Настоящие методические рекомендации могут быть использованы в учреждениях и организациях, производящих или использующих сыворотку КРС при получении медицинских и биолргических препаратов, а также при проведении научно-исследовательских работ. В рекомендациях дается описание методов очистки сыворотки и проверки ее качества.
1. Описание метода очистки сыворотки.
1.1. Основу предлагаемого метода составляет способ очистки сыворотки крови крупного рогатого скота от гамма-глобул и новой фракции белков, вирусов, микоплазм с помощью раствора полиэтнленгликоля. После обработки сыворотка сохраняет хорошие ростовые свойства для клеточных культур.
1.2. Приготовление раствора полиэтиленгликоля. Для обработки
сывороток используется иолиэтиленглико-^ь с плотностью 5000—7500. Для приготовления рабочего раствора к навеске полиэтиленгликоля (ПЭГ) в 30—40 г добавляют 100 мл дистиллированной воды или деминерализованной воды и прогревают полученную взвесь на водяной бане под ватно-марлевой пробкой до полного растворения препарата. Полученный раствор стерилизуют автоклавированием при 120—130°С в течение 2 ч. При необходимости раствор ПЭГ может быть стерилизован описанным выше способом повторно.
1.3. Используемые сыворотки. Для обработки могут быть использованы нативные или лиофилизированные- сыворотки крови крупного рогатого скота вне зависимости от предварительной их термоипактива-ции. Если исходная сыворотка предварительно прошла стадию стерилизующей фильтрации, следует пользоваться стерильным раствором ПЭГ, и обработанную сыворотку можно повторно не стерилизовать. Если же сыворотка не была предварительно простерилизована, то целесообразно использовать нестерильный раствор ПЭГ. Последующая стерилизующая фильтрация обработанной ПЭГ сыворотки будет проходить быстрее и легче, так как содержание белка в препарате в результате воздействия ПЭГ снизится в среднем на 50—60% в основном за счет уменьшения в 4—8 раз гамма-глобул и новой фракции белков, содержащей антитела к возбудителям заболеваний КРС.
1.4. Очистка сыворотки.
1.4.1. Для очистки к сыворотке добавляют раствор полиэтилен-гликоля при соотношении их объемов 4:1. Полученную взвесь тщательно встряхивают и выдерживают в течение 18—24 ч при температуре 1—10°С. Затем сыворотку центрифугируют при 2000—3000 об/мин 20 мин. В результате центрифугирования образуется плотный осадок, содержащий полиэтиленгликоль и глобулиновую фракцию белков. Надосадочную жидкость осторожно отделяют от осадка и используют в дальнейшей работе. Все манипуляции по очистке сыворотки следует проводить в стерильном боксе при соблюдении правил асептики.
При хранении сыворотки возможно появление незначительной опалесценции. Для осветления сыворотку рекомендуется повторно центрифугировать при 2000—3000 об/мин 20 мин. Качество сыворотки при этом не изменяется. Кроме того, опалесценция исчезает при добавлении сыворотки к питательной среде.
1.4.2. В результате обработки полиэтиленгликолем общее содержание белка в сыворотке снижается в среднем до 4—4,5%. Известно, что различные линии клеток при культивировании испытывают рачЗлич-ную потребность в сывороточных ростостимулирующих белках, поэтому при необходимости возможно повышение количества сыворотки до 20—25% от общего объема питательной смеси.
2, Определение качества сыворотки после обработки полиэтиленгликолем.
2.1. Качество обработанной ПЭГ сыворотки рекомендуется определять по следующим параметрам: общий белок, фракционный состав белка, ростостимулирующая активность, наличие специфических антител, pH, стерильность, контаминация вирусами, контаминация миконлаз-мами.
2.2. Определение общего белка.
2.2.1. Общий белок в сыворотке определяют в соответствии с «Методическими указаниями по применению унифицированных клинических лабораторных методов исследований» (М.: 1973, с. 45—46).
П р и н ц и п. Белки реагируют в щелочной среде с сернокислой
медью с образованием соединений, окрашенных в фиолетовый цвет (биуретовая реакция).
2.2.2. Реактивы:
0,9%-ный раствор хлористого натрия. ГОСТ 4233-77;
0,2 н. раствор едкого натрия (ГОСТ 4328-77), свободный от углекислого газа;
биуретовый реактив — 4,5 г сегнетовой соли (ГОСТ 5845-79) растворяют в 40 мл 0,2 н. раствора едкого натрия. Затем прибавляют 1,5 г сернокислой меди (ТУ 6-09-4525—77) и 0,5 г йодистого калия (ГОСТ 4232-74). Раствор доливают до 100 мл раствором 0,2 н. едкого натрия. Хранят в посуде из темного стекла. Реактив стоек;
0,5%-ный раствор йодистого калия в 0,2 н. растворе едкого натрия. Хранят в посуде из темного стекла не более 2 нед;
рабочий раствор биуретового реактива — 20 мл биуретового реактива с 80 мл раствора йодистого калия. Раствор стоек;
стандартный раствор альбумина (из человеческой или бычьей сыворотки). 10%-ный раствор альбумина (ТУ-6-09-10-342—75) в 0,9%-ном растворе хлористого натрия. I мл раствора содержит 0,1 г белка.
2.2.3. Специальное обор удов ан и е:-
фотоэлектроколориметр;
колбы мерные.
2.2.4. Ход определения. К 1 мл сыворотки прибавляют 5 мл рабочего раствора биуретового реактива, смешивают, избегая- образования пены. Через 30 мин (и не позднее чем через час) измеряют на ФЭКе в кювете с толщиной слоя 1 см при длине волны 540—560 нм (зеленый светофильтр), против контроля.
2.2.5. Контроль. К 5 мл рабочего биуретового реактива прибавляю 1,0 мл 0,9%-ного раствора хлористого натрия, далее обрабатывают, как опыт. Расчет ведут по калибровочному графику.
0,9%-ныЙ раствор хлористого натрия, мл
Концентрация белка, %
Номер Стандартный раствор
пробнркн белка, мл
Построение калибровочного графика. Из стандартного раствора готовят рабочие стандартные растворы, как указано ниже.
|
1 |
0,2 |
0,8 |
2 |
|
2 |
0,4 |
0,6 |
4 |
|
3 |
0,6 |
0,4 |
6 |
|
4 |
0,8 |
0,2 |
8 |
Из каждого разведения берут по 0,1 мл рабочего раствора и прибавляют по 5 мл рабочего биуретового реактива, через 30—60 мин измеряют на ФЭКе, как в опыте, против контроля. По полученным данным строят калибровочный график.
2.2.6. Перед определением общего белка сыворотку следует развести в 10 раз и это разведение учесть при его подсчете.
2.2.7. При содержании в сыворотке белка больше 10% сыворотку разводят физиологическим раствором, а результаты умножают на коэффициент разведения.
2.2.8. Все реактивы готовят на прокипяченной дистиллированной воде.
2.2.9. Содержание общего белка в обработанной сыворотке не должно превышать 4—4,5%.
2.3. Определение фракционного состава белков сыворотки.
2.3.1. Фракционный состав белков сыворотки определяют в соответствии с действующими «Методическими указаниями по применению физико-химических и химических методов контроля медицинских биологических препаратов», утвержденными Министерством здравоохранения СССР 5 августа 1977 г. Метод основан на том, что молекулы белка, содержащие как основные, так и кислые группы, перемещаются в электрическом поле с различной скоростью в зависимости от соотношения этих групп, pH и ионной силы буферного раствора.
2.3.2. Методика определения. Электрофоретическое разведение проводят в меди нал-вер он ал овом буферном растворе с pH 8,6 и с ионной силой 0,05 при градиенте потенциала от 3 до 8 В на 1 см длины бумажной полосы. Сила тока не должна превышать 0,3 мА на каждый сантиметр поперечника бумажной полосы, т. е. не более 1,2 мА на полосу шириной 4 см.
После того как бумажные полосы в приборе пропитываются буферным раствором при напряжении 300—400 В в течение 30—40 мин, препарат наносят со стороны катода в виде узкой полосы в количестве 0,01 мл. Электрофорез проводят при комнатной температуре в течение 18 ч. После окончания электрофореза бумажные полосы помещают в горизонтальном положении в сушильный шкаф на 20 мин при 100°С. Окраска электрофореграмм проводится в течение 20 мин при погружении полосы в раствор красителя. Краситель, не связавшийся с белком, отмывают 3—4 раза по 20 мин 20%-ным раствором уксусной кислоты.
В случае неоднородности иммуноглобулина количественное определение фракции проводят с помощью фотоэлектроколориметра. Для этого с двух параллельных электрофореграмм вырезают фракции. Одинаковые фракции с двух параллельных электрофореграмм помещают в одну пробирку и элюируют в 0,1 в. растворе едкого натрия. Продолжительность элюции — 30 мин. После центрифугирования измеряют on-, тическую плотность элюатов на фотоэлектроколориметре с красным светофильтром (—590/нм) в кюветах с толщиной слоя 10 мм против элюатов с контрольного (неокрашенного) участка электрофореграммы. По полученным данным подсчитывают содержание фракций в препарате. Сумму экстинций принимают за 100% и вычисляют процент содержания примеси компонентов.
2.3.3. Приготовление веронал-мединалового буферного раствора pH 8,6. В 300 мл дистиллированной воды растворяют 10,23 г м един ала, добавляют 1,84 г веронала и, помешивая, нагревают на водяной бане до растворения веронала. Затем объем раствора доводят до 1 л водой.
2.3.4. Приготовление красителя. К 0,2 г амидочерного (реанял ВНР) 10 В добавляют 100 мл ледяной уксусной кислоты и 900 мл метилового спирта.
2.3.5. Приготовление раствора для смывания электрофореграмм. 200 мл ледяной уксусной кислоты (ГОСТ 61-75) доводят до 1 л водой.
2.3.6. Рекомендуется бумага для хроматографии марки М, разрезанная на полосы шириной 4 см, длиной 40—44 см.
2.3.7. В обработанной сыворотке процентное содержание глобули-новой фракции должно находиться в следующих пределах:
альфа-глобулины —* 22±4% ;
бета-глобулины — 23 ±8%;
гамма-глобулниы — не более 8—10%.
2.4. Определение ростостимулирующей активности сыпороткн.
2.4.1. В качестве тест-культур используют диплоидные клетки че-
ловека (штамм ДКЧ или любой другой 20—40 пассажей) или кожно-мышечные клетки куриных эмбрионов.
2.4.1.1. Контроль сыворотки на диплоидных клетках. Диплоидные клетки культивируют на протяжении 5 пассажей, пересевая их через 3—4 дня в соотношении 1 : 2. Исходная посевная доза клеток 100— 200 тыс/мл (33—66 тыс/мл на 1 см2 поверхности флаконов). На каждый пассаж берут не менее трех культуральных флаконов (матрасов).
В качестве питательной среды используют среду Игла (БЕМ) с глютамином. Испытуемую сыворотку добавляют к среде в количестве 10%. При пассажироваиии клетки снимают с поверхности стекла культуральных матрасов 0,25%-ным раствором трипсина Дифко, подогретым до 37°С.
После пятого пассажа производится подсчет клеток в камере Горяева. За жизнеспособные принимаются клетки, которые не воспринимают трипановой сини при смешивании 1%-ного раствора этого красителя с клеточной суспензией в равных количествах (по 0,5 мл).
Сыворотка считается пригодной для работы, если она, как и в контроле, обеспечивает в каждом пассаже формирование монослоя в культуральных матрасах, не вызывает дегенеративных изменений в клетках (вакуолизации, крупной зернистости и т. д.) и дает после пятого пассажа не менее чем двукратный их прирост. Контроль к опыту ставится по аналогичной методике с нативной сывороткой крупного рогатого скота.
2.4.1.2. Контроль сыворотки на кожно-мыинечных клетках куриных эмбрионов. Используют тушки 9—10-дневных куриных эмбрионов. Перед извлечением тушек скорлупу яиц обрабатывают спиртом и обжигают спиртовым «ватиком» область пуги. В этом месте срезают скорлупу, пинцетом перфорируют хорионаллантоисную оболочку, извлекают эмбрион, фиксируя его за шейку, и переносят в чашку Петри. Далее отделяют от туловища эмбриона голову, конечности, удаляют внутренности. После этого тушки переносят в небольшие широкогорлые банки и измельчают их ткань на кусочки размером 2—3 мм. Последние промывают от остатков крови раствором Хенкса с антибиотиками (200 000 ЕД пенициллина и 200 мкг стрептомицина на 1 л), промывную жидкость сливают и добавляют 0,25%-ный раствор трипсина. Трипсинизацию ведут «дробно» с интервалами 10—15 мин при комнатной температуре. На каждый цикл трппсипизации расходуют 15—20 мл трипсина из расчета на одну тушку. Количество используемых тушек и циклов трип-синизации определяется потребным количеством клеток.
После окончания трипсинизации клеточную взвесь центрифугируют при 800—1000 об/мин 7—10 мин, надосадочную жидкость сливают, а осадок клеток ресуспендируют в питательной среде. В качестве питательной среды используют 0,5%-ный раствор гидролизата лактальбу-мина. Испытуемую сыворотку добавляют в количестве 10%. Посевная доза — 300 тыс. клеток на 1 мл или 100—150 тыс. клеток на 1 см2 культурального флакона. На каждый образец испытуемой сыворотки берут по 3—4 культуральных флакона. Контролем служит нативная сыворотка крупного рогатого скота.
Сыворотка считается пригодной для использования, если она обеспечивает: образование сплошного слоя клеток на 3—4-е сут от начала культивирования, не вызывает в клетках изменений дегенеративного характера (вакуоли, темная зернистость и т. д.) и обеспечивает индекс пролиферации клеток не менее единицы.
2.4.2. Подсчет индекса пролиферации. Индекс пролиферации — это отношение числа выросших клеток к количеству засеянных. Для