Методические указания по лабораторной диагностике катаральной лихорадки крупного рогатого скота, овец и коз
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Оглавление
1. Общие положения
2. Патологогистологическое исследование
3. Вирусологическое исследование
3.1. Подготовка материала к исследованию
3.2. Выделение вируса на культуре клеток
3.3. Выделение вируса на куриных эмбрионах
3.4. Идентификация вируса
4. Биологическое исследование
5. Серологическая диагностика
6. Диагноз на катаральную лихорадку
Приложение. Катаральная лихорадка овец, крупного рогатого скота (справка)
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.02.2020 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.220 Ветеринария
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
| Издан | Лань | 2015 г. |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12
стр. 13

стр. 14
стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24

стр. 25

стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
|
ВЕТЕРИНАРНАЯ мрпишинл |
ЛАБОРАТОРНАЯ ДИАГНОСТИКА ВИРУСНЫХ БОЛЕЗНЕЙ ЖИВОТНЫХ
- САНКТ-ПЕТЕРБУРГ -•МОСКВА* •КРАСНОДАР* •2015*
?. SO.UMKU. общие для асгх или нескольких видов животных
»11штпггт1Уилш1ШШ^я»шашаии1м**У1111*1ЫкйШ11»Ш11>11МШ***-щтт11ят*иш
4.1. Для постановки биологической пробы используют овец породы «прекос» G...8-месячного возраста из хозяйства, благополучного по инфекционным болезням.
Перед заражением исследуют сыворотку крови овец на наличие антител к вирусу катаральной лихорадки в РДСК и РДП.
4.2. Биопрсбу ставят на двух овцах, которым вводят суспензию исследуемого материала внутривенно в дозе 10 мл.
4.3. Результаты биологического исследования считают положительными в случае повышения температуры (до 41...42СС) у овец на 5,,.7-й день после заражения; появления гиперемии слизистых оболочек рта и носа, отека губ, языка; эрозии в уголках губ, на деснах, языке; угнетения; поражения конечностей; цианоза слизистых оболочек и языка у отдельных овец, выпадения шерсти.
4.4. При отсутствии характерных клинических симптомов заболевания катаральной лихорадкой от зараженных овец берут пробу крови в период температурной реакции (или на 5...7-е сутки после заражения) для выделения вируса на культуре клеток (см. п. 3.2) и через 2...3 недели после заражения исследуют сыворотки крови в РДСК, РДП для обнаружения специфических антител.
5. Серологическая диагностика.
5.1. Реакция длительного связывания комплемента (РДСК) и реакция диффузионной преципитации в агаровом геле (РДП) — групповые специфические методы, применяемые для обнаружения антител к вирусу катаральной лихорадки в сыворотке крови овец, коз и крупного рогатого скота, переболевших данной болезнью (ретроспективная диагностика).
У крупного рогатого скота серологическая реакция на вирус может быть слабой, поэтому при постановке РДСК антиген берут в меньшем разведении.
5.2. Реакция длительного связывания комплемента.
5.2.1. Компоненты реакции:
■ сыворотки испытуемые и контрольные (специфическая
и контрольная);
■ антигены — специфический и нормальный: м эритроциты барака— 2%-ная взвесь;
114
мммглиммш «utd чти ягцммимж
■ гемолитическая сыворотка (гемолизин) биофабричного производстве;
■ комплемент —бисфабри'шого производства или свежая сыворотка морской свинки;
■ 0,85% -ный раствор химически чистого хлорида натрия на дистиллированной воде, pH 7,2...7,4.
5.2.2. Подготовка компонентов реакции.
Испытуемые сыворотки разводят физиологическим раствором в отношении 1:8, контрольные — до рабочего разведении, укаэишкл'О на этикетке. Разведенные сыворотки мелкого рогатого скота инактивируют 30 мин при 60°С, крупного рогатого скота — при 586С.
Проросшие и гемолизированные сыворотки для исследования непригодны.
Специфический и нормальный антигены разводят физиологическим раствором до объема, указанного на этикетке. При исследовании сывороток крупного рогатого скота рабочее разведение антигенов в два раза ниже указанного на этикетке.
Эритроциты барана отмывают физиологическим раствором путем центрифугирования при 2500...3060 об/мин в течение 10 мин до полной прозрачности надосадочной жидкости и готовят 2%-ную взвесь из осадка.
Гемолизин используют в четырехкратном титре. Так, при титре гемолизина 1:8000 его рабочее разведение 1:750.
Для приготовления гемолитической системы гемолизин в рабочем разведении смешивают с равным объемом 2%-ной взвеси эритроцитов и выдерживают 20...30 мин при комнатной температуре.
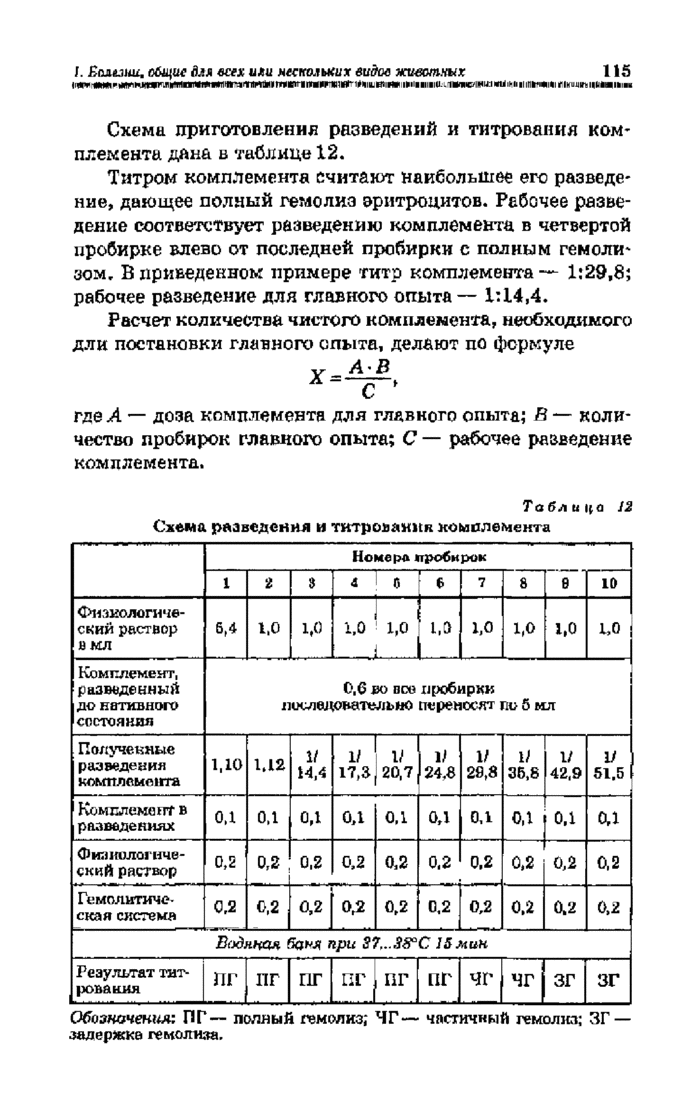
Комплемент титруют в гемолитической системе перед каждой постановкой реакции. Для этого берут 10 пробирок. В первую вносят 5,4 мл, а в остальные по 1 мл физиологического раствора. Затем в первую пробирку добавляют 0,6 мл разведенного до первоначального объема комплемента, хорошо перемешивают и переносят 5 мл во вторую пробирку, из второй — 5 мл в третью и т. д. Получают ряд последовательных разведений комплемента от 1:10 до 1:51,5. Для определения титра комплемента из каждого его разведения переносят по 0,1 мл в соответствующую пробирку основного ряда.
/. Ладош. общие для всех или нескольких видео животных 115
г«*-йМ'|М^км^лгмп1«т««11>»^пг1П«1Гт«к)гапга«г«1»Г1»Ч11.в9Яг i»iaaiBiu..iMP&’iMu-j«u»tiiin»4Mii«iri«iiuvtiiiiaBitiH
Схема приготовления разведений и титрования комплемента дана б таблице 12.
Титром комплемента считают наибольшее его разведение, дающее полный гемолиз эритроцитов. Рабочее разведение соответствует разведению комплемента в четвертой пробирке влево от последней пробирки с полным гемоли* зом. В приведенном примере титр комплемента—- 1:29,8; рабочее разведение для главного опыта — 1:14,4.
Расчет количества чистого комплемента, необходимого дли постановки главного опыта, делают по формуле
Y А* В
где А — доза комплемента для главного опыта; Я — количество пробирок главного опыта; С — рабочее разведение комплемента.
|
Т а б л u i(0 J2 Окема разведения и титровании комплемента | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Обозначения: ПГ — полный гемолиз; ЧГ— частичный гемолиз; ЗГ— задержке гемолиза. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Яайоршхориал (tiuunocmuKa веррош* Лолпней животных тщышнт1ят>тттт*тшвшвштттшап*ы —и— я ими—
НС
Например, для постановки реакции в 100 пробирках
требуется неразделенного комплемента:
0,1-100 Л СЛ
-■■■ ■ , =0,60 мл.
14,4
Количество разведенного комплемента для всей реакции составляет 10 мл (0,1 -100), следовательно к 0,69 мл комплемента добавляют 9,31 мл физиологического раствора.
5.2.3. Постановка главного опыта.
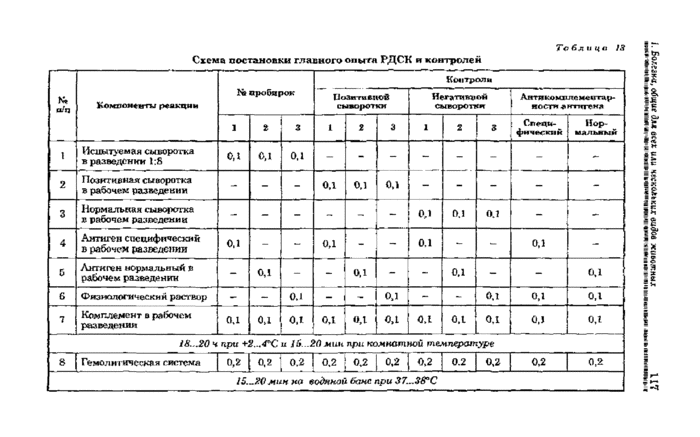
Реакцию ставят в объеме 0,5 мл в пробирках Флоринского. Каждую разведенную инактивированную сыворотку (см. п, 5.2.2) разливают в три пробирки по ОД мл. В каждую первую пробирку добавляют 0,1мл специфического антигена, во вторую 0,1 мл нормального антигена, в третью — 0,1 мл физиологического раствора. Затем во все пробирки вносят по 0,1 мд комплемента в рабочем разведении и реакцию помещают на холод при +2...-4вС на 18..,20 ч. После реакцию выдерживают в течение 15... 20 мин при комнатной температуре и в каждую пробирку добавляют по 0,2 мл гемолитической системы, пробирки встряхивают и помещают на водяную баню при 37...38аС на 15...20 мин.
Одновременно с главным опытом ставят следующие контроля: позитивной и негативной сывороток в разведениях, указанных на этикетке по схеме главного опыта; специфического и нормального антигенов — на антикомплементар-ность.
Схема постановки главного опыта и контролей представлена в таблице 13.
6.2.4. Результаты реакция учитывают через 25...30 мин после выемки штативов из водяной бани.
Результаты реакции считают действительными при следующих показаниях контролей:
■ задержка гемолиза — в пробирке с позитивной сывороткой и специфическим антигеном;
Ш полный гемолиз — в пробирках с позитивной и негативной сыворотками без антигенов и с нормальным антигеном, негативной сывороткой со специфическим антигеном, а также в контролях антигенов на антиком-плементярность.
|
Схема постановки главного опыта РДСК и контролен | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ГоКлнцп /.? |
5.2.5. Оценку результатов реакции проводят по степени задержки гемолиза эритроцитов и выражают крестами: ++++ (4 креста) — отсутствие гемолиза, надосадоч-ная жидкость прозрачная; +++ {3 креста) — гемолиз 25% эритроцитов; +4- (2 креста) — гемолиз 50% эритроцитов; + (1 крест) — гемолиз 75% эритроцитов; - (минус) — полный гемолиз эритроцитов, осадок отсутствует.
5.2.6. Реакцию считают:
■ положительной — при задержке гемолиза эритроцитов на 3...4 креста;
В сомнительной — при задержке гемолиза на 2 креста;
В отрицательной — при задержке гемолиза на 1 крестили полном гемолизе эритроцитов.
5.2.7. При получении сомнительных результатов сыворотку крови от таких животных исследуют повторно через 14. ..21 день. При повторном получении сомнительной реакции результат исследования считают отрицательным.
5.3. Реакция диффузионной преципитации.
5.3.1. Прецинитирующие антитела обнаруживают в сыворотке крови в течение года с момента переболевания.
5.3.2. Компоненты реакции и подготовка их к работе:
В специфический прецигштирующий антиген, приготовленный из аттенуированного штамма вируса катаральной лихорадки, выпускается в лнофилиэированном состоянии. Перед применением антиген разводят физиологическим раствором или дистиллированной водой до исходного объема и готовят рабочее разведение, как указано на этикетке;
а нормальный антиген, приготовленный из неинфициро-винных клеточных культур, используют в тех же разведениях, что и специфический;
■ испытуемые сыворотки от больных или переболевших животных должны быть прозрачными, без примеси эритроцитов. При длительном хранении сывороток (не более бмес.) допускается консервирование их замораживанием;
■ специфическая и нормальная контрольные сыворотка, которые разводят физиологическим раствором или ди-
t. Болезни, с.4щие дли всех или нескольких видов яаммш* 119
шмп la kLrtdJMi м1ы»ьшмц. «ц ■:<«■■! ц t .Hni,nn>jjiiuiiiiimmi^fc.aiA»i линииjUbiwuw, лми—i ни— *m
стиллироваыиой водой до исходного объема, указанного на этикетке;
• агар «Дифко», отечественный или японский агар-агар.
Агар-агар промывают проточной водопроводной водой в течение 24 ч, затем дистиллированной — в течение того же времени. После промывания агар отжимают и высушивают на стекле до первоначального веса.
Для постановки РДП готовят 1%-ныЙ агаровый гель на физиологическом растворе с добавлением риванола (10 мг на 1 л геля).
Расславленный агаровый гель разливают в чашки Петри, установленные в строго горизонтальном положении слоем в 0,4...0,5 см и дают застыть. В затвердевшем агаре с помощью штампа делают лунки диаметром 7 мм, расстояние между краями лунок 3 мм. На одной чашке Петри можно расположить 4 фигуры по 7 лунок в каждой (1 в центре, 6 вокруг). Агар из лунок удаляют с помощью вакуума, пастеровской пипетки или пинцета.
5.3.3. Постановка реакции.
Каждую сыворотку испытывают одновременно со специфическим и нормальным антигенами. Сыворотки и антигены разливают в объеме 0,05 мл. Специфический антиген вносят в центральную лунку одной из фигур, нормальный — в центральную лунку соседней фигуры. Испытуемые сыворотки вносят в периферические, аналогично расположенные лунки обоих фигур. Одновременно в одной из чашек ставят контроли специфической и нормальной сыворотки с обоими антигенами.
В каждой чашке Петри можно исследовать 12 сывороток со специфическим и нормальным аптигенами (см. рис. 8).
Поело внесения компонентов чашки закрывают крышками и выдерживают 24,.,48 ч при комнатной температуре.
5.3.4. Учет и оценка результатов РДП.
Реакцию учитывают черва 24...48 ч в проходящем свете.
Показания реакции считают действительными при получении следующих результатов контрслей: ннличие линии преципитации между лунками со специфическими антигеном и сывороткой и отсутствие такой линии между лунками с нормальным антигеном и контрольными
Р«е.8
Схема расположена* лунок о'чашке Петри и заполнения их диагностикумами и испытуемыми сыворотками при постановке РДП:
Ас — антиген сцнцифнческий; Ан — антиген нормальный; Сс — сыворотка с.лецифичеекыч; Си ~ сыворотка нормальна*; 1...10 — сыворотки испытуемые.
сыворотками (специфической и нормальной), а также специфическим антигеном и нормальной сывороткой.
Реакцию с испытуемой сывороткой считают положительной при наличии линии преципитации между лунками со специфическим антигеном и данной сывороткой и отсутствии такой линии между лутками с этой же сывороткой и нормальным антигеном.
При отрицательной реакции линия преципитации между испытуемой сывороткой и специфическим антигеном отсутствует.
б. Диагноз на катаральную лихорадку.
6.1. Диагноз на катаральную лихорадку крупного рогатого скота, овец, коз ставят на основании комплекса апизоо-тологических, клинических, патологоанатомических данных, а также результатов вирусологических, патологогистологических и серологических исследований.
Щтодогогистологические и серологические исследования необходимы для постановки предварительного диагноза.
Окончательный диагноз на катаральную лихорадку устанавливают на основании выделения, идентификации и типиронания вируса.
6.2. Сроки исследований:
■ патологогистологическвх — 12 дней;
■ вирусологических — 10...30 дней;
■ серологических — 4 дня;
■ биологической пробы — 7...20 дней.
ПРИЛОЖЕНИЕ к Методическим указаниям по лабораторной диагностике катаральной лихорадки крупного рогатого скота и овец.
Катаральная лихорадка опец, крупного рогатого скота (справка).
1. Элизоотологические данные.
В естественных условиях к вирусу катаральной лихорадки восприимчивы овцы, особенно в молодом возрасте (от б мес. до 1 года). Овцы европейских пород более чувствительны, чем животные африканских и азиатских пород. Крупный рогатый скот, буйволы, козы и другие жвачные животные длительное время могут быть вирусокосите-лями, не проявляя клинических признаков болезни.
Возбудитель от больных животных к здоровым передается кровососущими насекомыми (мокрецы). Заболевание отмечается в период активного лета кровососущих насекомых (летне-осенний) в местах их массового обитания (природный очаг). Болезнь чаще встречается в долинах, вблизи рек, водоемов. Обычно погибает от 2 до 30% овец, ко иногда летальность достигает 90... 100%.
2. Клинические признаки.
Инкубационный период болезни при естественном заражении 6...3 дней, при экспериментальном — 4,..5сут. При остром течении болезни отмечают лихорадку (40,5...426С), гиперемию слизистой оболочки ротовой и носовой полостей; кровоизлияния, арозии и язвы на слизистой губ, языка, десен, щек; повышенную саливацию («влажный рот»), водянистые с переходом в слизисто-гнойные истечения из носа, отек век, ноздрей, губ, подчелюстного пространства, шеи и груди; резкое опухание и багрово-синее окрашивание языка, иногда выпадение его через беззубый край, ихорозный запах изо рта; диарею.
У переболевших овец иногда наблюдают хромоту (воспаление венчика), искривление шеи и выпадение шерсти.
При подостром течении отмечают сильное истощение, слабость и медленное выздоровление.
При абортивной форме выявляют кратковременное повышение температуры тела и быстро проходящую гиперемию слизистой оболочки ротовой полости.
122 Либсроториал диагностика вирусных болезней животных
патч» им«.н*ммм1 * шит.*имении«чмл и-1; ап намни* мМйя.ш H*i«« 1»ииюшл;ш
3. Иатологоаннтомичеекие изменения.
Характерными являются следующие паголйгоанатоми-ческие признаки:
■ студенистый отек подкожной клетчатки губ, ноздрей, век, щек, подчелюстного пространства, шеи, подгрудка, паха;
S диффузное помутнение роговой оболочки глаза (кератит);
Щ цианоз и ияълзвленке слизистой оболочки Языка, губ и десен;
■ отек языка, кровоизлияния, эрозии и очаги некроза на его латеральной поверхности;
■ пятнист о-полосчатыс кровоизлияния и отек скелетных мышц (преимущественно в области шеи, плеч, спины и поясницы);
■ множественные кровоизлияния, эрозии и язвы на слизистой оболочке рубца, кровоподтеки и кровоизлияния на границе книжки с сеткой, некротическое изъязвление слизистой оболочки дна (жолоба) книжки;
■ множественные кровоизлияния в сердце, легких, печени, почках, сычуге, кишечнике, лимфатических узлах и селезенке.
Катаральную лихорадку необходимо дифференцировать от болезни Найроби, ящура, оспы, контагиозной эктимы и иекробактериоза.
ЛАБОРАТОРНАЯ ДИАГНОСТИКА ВИРУСНЫХ БОЛЕЗНЕЙ ЖИВОТНЫХ
Составители:
П. И, Барышников,
В. В, Разумовская
Издание второе, исправленное
ДОПУЩЕНО
Мин ист*per, \ сом сельскою хозяйства РФ в качестве учебные пособия для студентов вузов. обучающихся по направлению подготовки {специальностей 'Ветеринария*
ДОПУЩЕНО
У МО oysaa РФ па образованию в области зоотехнии и ветеринарии а качестве учебного пособия для студентов вузов, обучающихся по направлению подготовки (специальности.) * Ветеринария*
(квалификация (степень) 'Ветеринарный врач*)
•САНКТ-ПЕТЕРБУРГ* МОСКВА • КРАСНОДАР* •2015.
КРАТКИЙ СЛОВАРЬ ИСПОЛЬЗОВАННЫХ ВЕТЕРИНАРНЫХ ТЕРМИНОВ
Антигены (анти + грсч. genes — порождающий) — чужеродные для организма высокомолекулярные органические вещества коллоидной структуры (белки, белково-липидные и бе.тково-оолисахаридные комплексы), способные при поступлении (введении парентерально) вызывать синтез особых глобулинов-антител И вступать в специфическое взаимодействие с ними.
Антитела (анти, + тело) — противотела — специфические болки (иммупоглобулины), образующиеся в организме под воздействием антигенов. Они накапливаются в сыворотке крови и тканях, вступают в специфическую связь с соответствующими антигенами и разрушают или обезвреживают их.
Биологическая проба (биопроба) — один из методов диагностики инфекционных болезней с помощью заражения патологическим материалом подопытных животных (куриных эмбрионов, культур клеток) и их исследования.
Ннрион — полноценная внеклеточная вирусная частица.
Вирусовиделокис — выделение возбудителей инфекции из opiTLHизма больного животного или вирусоносителн.
Внрусоносительство — наличке возбудителя инфекции в определенных органах и тканях клинически здорового животного, не сопровождающееся иммунологической перестройкой организма.
Вирусы (лат. virus — яд) — облигатные внутриклеточные паразиты, отличающиеся от растительных и животных организмов малыми размерами, отсутствием клеточного строения и автономного метаболизма, наличном только одного типа нуклеиновой кислоты и деэъюнхтивным способом размножения.
ББК 48.7я 73 Л 12
Л 12 Лабораторная диагностика вирусных болезней животных / Сост. ГТ- И. Барышников, В. В. Разумов* скал: Учебное пособие. — 2-е иэд., испр. — СПб.: Издательство *Лань*, 2015.— 672с.: ил.— (Учебники для вузов. Специальная литература)*
ISBN 978-5-8114-1882-4
Учебное издание содержит дейстнукяцке католические указания. наставления я инструкции по лабораторной диагностике эн-руекых болезней животных, утвержденные Министерством сельского хозяйства СССР. РФ я Россел^хознадзорок РФ. Документы систематизированы по ьадам животных, в большинство пролит многолетнюю arm роба ц ню в Алтайской краевой ветеринарной да боратории и включены в «Перечень нормативной документации, разрешенной для использования в государственных еетерипарных лабораториях при диагностике болезней животных, рыб, пчел, я такжс контрола безопасности сырья животного и растительного происхождения* (по состоянию на июль 2011 г.). Приводятся пред* метный указатель и библиографический список.
Предназначено для студентов, обучающихся по специальное-тн «Ветеринария* и направлению «Ветеринарно-санитарная экспертиза*, ветеринарных орлчей и лаборантов ветеринарных лабораторий.
ББК 48.7я73
Рецензенты:
И. Я. ГУСЛАВСКИЙ — доктор ветеринарных наук, профессор кафедры микробиологии, эпизоотологии, плреактологии и ВСЭ Алтайского государственного аграрного университета*,
В. И. ПЛЕШАКОВА — доктор ветеринарных наук, профессор, зав. кафедрой ветеринирней микробиологии, вирусологии к иммунологии Омского государственного аграрного университета им. П. А. Столыпина;
В. А СИНИЦЫН —• доктор ветеринарных наук, зап. отделом ФГБУ • Новосибирская межрегиональная Ветеринарная лаборатория*.
Обложка Издательство «Лань*, 2015 Е. А. ВЛАСОВА О Коллектив авторов. 2015 ® Иэдяте-льстяо «Лань*,
художественное оформление, 2015
I Волши. oOm 9л» осел иль iiearon/ctur видоо ииастпш 107
•m*«№a«>iiiira№M>iUi* «л пшипша mm niMiuimniiautiiuaiaiiiHmuaiilEiamiiiuluiua таи
КАТАРАЛЬНАЯ ЛИХОРАДКА КРУПНОГО РОГАТОГО СКОТА, ОВЕЦ И КОЗ
1.7.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ЛАПОРАТОРНОЙ ДИАГНОСТИКЕ КАТАРАЛЬНОЙ ЛИХОРАДКИ КРУПНОГО РОГАТОГО СКОТА, ОВЕЦ И КОЗ
(утверждены И июня 1S86 г., № 432Б)
I. Общие положения.
1.1. Лабораторные методы исследования на катаральную лихорадку крупного рогатого скота, овец и коз включают в себя следующие:
ш патсгистологическое исследование;
■ выделение вируса на культуре клеток и куриных эмбрионах с последующей идентификацией в реакции им-мунофлуоресценции (ИФ);
■ выявление группоспецифических антител в сыворотках крови больных или переболевших животных в РДСК, РДП;
■ постановку биологической пробы на овцах (в сомнительных случаях).
Выделение и идентификацию вируса, исследования сывороток крови животных ветеринарные лаборатории проводят группоспецифическими методами. Окончательное титрование вируса по 23 серологическим вариантам в реакции нейтрализации проводят во Всесоюзном научно-исследовательском институте ветеринарной вирусологии и микробиологии (ВНИИВВиМ).
1.2. В лабораторию для исследования на катаральную лихорадку направляют:
■ кусочки селезенки и лимфатические узлы от павших или убитых животных в свежем виде или консервиро-
108 Ясбирвмсрмах диагностъка вирусных бслгхнгй животных
П МИМ|»'11«ШМИЧ|*1<Ч»Я 1' "*«и шуши*, ■ llliajiarlhlM ■■mi Uhl ИМИ яигмли I IMBUlh#N»MM и,Я|
ванные 30%-ным раствором глицерина, приготовленным на фосфатно-буферном растворе (pH 7,2...7,4);
■ пробы крови от больных животных, взятые в период температуркой реакции вофлаконыв количестве 10 мл, пробы стабилизируют равным объемом антикоагулянта — раствором Эдинстона следующего состава: щавелевокислый калий — 5 г, карболовая кислота — 5 г, глицерин — 500 мл, дистиллированная вода — 500 мл;
■ кусочки скелетных мышц, сердца, языка, губ. стенок книжки и рубца, фиксированные 10% -ным раствором формалина для патологогистологического исследования, а также нефиксированные кусочки лимфатических узлов, селезенки, легких, печени и почек с надпочечниками;
■ сыворотку крови для серологических исследований от больных или переболевших животных я количестве
2.. .3 мл.
Патологический материал для вирусологических исследований отбирают не позднее, чем через два часа после гибели животных, в стерильные флаконы или пробирки и доставляют в лабораторию в термосе со льдом.
Сыворотку крови для серологических исследований можно сохранять при температуре -20°С и ниже. Консервирование сывороток химическими реактивами не допускается.
2, Патодогогистологичсское исследование.
2.1. Для гистологического исследования готовят парафиновые срезы из фиксированных 10% -ным раствором фор-маликакусочковскелетных мышц, сердца, языка, губ, стенок книжки и рубца и окрашивают гематоксилшгоозином.
Для выявления внутриклеточных цитоплазматических включений берут кусочки лимфатических узлов, сслозон-ки, легких и почек с надпочечниками, фиксируют их в жадности Карнуа (спирт этиловый — 60 мл, хлороформ — 30 мл, ледяная уксусная кислота — 10 мл) и заливают в парафин. Срезы окрашивают метиловым зеленым — пиро-ником или ШИК-реякцией.
При исследовании гистологических препаратов необходимо иметь в виду, что в случае заболевания животных
I. FvMjhu. общи* дм ectx t-iu песком*их 6udi* мчлотньi* 109
■IIIPVKI №in —Ц1—1—МИКИМЛМИРЦ WilHIl» n -«IIIAI» • ■ WWIM IHM* 'k !'■ I 111 URinmURMU
катаральной лихорадкой обнаруживают резко выраженные поражения микроциркуляторного русла в скелетных мышцах и мышечных волокнах сердца, языка, губ — колбовидное набухание, гомогенизацию, j-убчатый распад, лизис и некроз; в межмышечной соединительной ткани — сильный отек, кровоизлияния к лимфоидно-гистиоцитарньш инфильтрат; в стенках книжки и рубца — некроз покровного эпителия и основы слизистой оболочки, а также отек, диффузные кровоизлияния и лимфоидный инфильтрат в соединительной ткани подслизистого слоя.
При окраске специальными методами срезы просматривают под микроскопом с иммерсионной системой, причем в цитоплазме ретикулярных клеток и макрофагов лимфатических узлов и селезенки, в клетках легких, печени, почках и надпочечников могут быть найдены цитоплазматические включения округлой или овальной формы красного цвета {метод Браше), пурпурного или лилово-красного (ШИК-реакция). Часто обнаруживают значительное уменьшение количества лимфоцитов в селезенке и лимфатических узлах (опустошение).
2.2. По обнаруженным характерным патологогистоло-гическим изменениям и тельцам-включениям ставят предварительный диагноз на катаральную лихорадку овец.
3. Вирусологическое исследование.
3.1, Подготовка материала к исследованию.
3.1.1, Для проведения исследований из патологического материала (селезенки, лимфатических узлов) готовят 10% -ную суспензию на фосфатном буферном растворе (pH 7,4...7,6) или на питательной среде с 0,5% гидролизата лактальбумика, к которой добавляют 1000 ЕД пенициллина и 500 мкгстрептомицина на 1 мл. Патологический материал, консервированный глицерином, предварительно отмывают в фосфатном буферном растворе (pH 7,4...7,6).
Приготовленную суспензию центрифугирует 30 мин при 2000...3000 об/мин. Нядосадочную жидкость сливают в стерильную пробирку, помещают в холодильник и выдерживают при 2...4йС в течение 3...4 ч. Затем делают высевы на питательные среды (МПБ, МПА) для исключения бактериального загрязнения.
Через сутки, при отсутствии роста микрофлоры иа питательных средах, над осадочную жидкость используют для заражения клеточных культур и куриных эмбрионов.
3.1.2. Пробы крови с антикоагулянтом центрифугируют 10 мин при 1000 об/мин. Осадок эритроцитов трижды промывают стерильным физиологическим раствором (pH 7,2...7,4), затем готовят 20%-ную суспензию эритроцитов на фосфатном буферном растворе (pH 7,4...7,6) для заражения культур клеток и куриных эмбрионов,
3.2. Выделение вируса на культуре клеток.
3.2.1. Выделяют вирус на первично-трипсинизирован-ной культуре клеток почки ягнят (ПЯ) или перевиваемой линии клеток ВНК-21.
3.2.2. В митрвсы на 100 мл (не менее 5)с культурой клеток ПЯ или ВЩС-21 после удаления ростовой среды вносит
2.. .3мл суспензии исследуемого материала к равномерно распределяют ее по монослою клеток.
Матрасы помещают и термостат на 1 ч при 37°С, после чего вносят поддерживающую среду в количестве 10... 15 мл (для культуры клет ок ВПК-21 — среду Игла с двойной концентрацией аминокислот; для ПЯ — 0,5% -ный раствор гидролизата лактальбумина без сыворотки).
Контролем служат матрасы с незараженной культурой клеток, в которых ростовая среда заменена поддерживающей.
3.2.3. Матрасы, зараженные исследуемым материалом, и контрольные помещают в термостат при 37°С. Для учета цитопатического действия вируса (ЦПД) проводят ежедневно микроскопическое исследование клеточных культур в течение 7 дней.
3.2.4. Цитопатяческое действие вируса в культуре клеток ВНК-21 можно обнаружить через 36...40 ч по наличию округлых клеток, с последующим разрушением всего монослоя. ЦНД Birpyca в культуре клеток Т1Н проявляется на
6.. .7-й день зернистостью, округлением клеток, образованием тяжей, отслоением клеток от стекла.
В контрольных незараженкых культурах цитопатиче-ские изменения должны отсутствовать.
3.2.5. При выявлении в культурах ЦПД отбирают из матрасов культуральную жидкость в объеме 0,4 мл для заражения монослоя клеток аналогичной культуры, выращенных на стеклянных пластинках (стеклышках), в пробирках или пенициллиновых флаконах. После выдерживания зараженных культур в термостате при 37°С в течение 72 ч стеклышки извлекают, высушивают на воздухе, фиксируют 10 мин в охлажденном при температуре -20°С ацетоне и используют для идентификации вируса в иммуно-флуоресценции.
3.2.6. При отсутствии цитопатического действия вируса (ЦПД) провидят два последовательных пассажа в аналогичной клеточной культуре.
3.3. Выделение вируса на куриных эмбрионах.
3.3.1. Для выделения вируса на куриных эмбрионах (КЭ) суспензию исследуемого материала (см. п. 3.1) вводят
8...9-дневкым КЭ в желточный мешок в дозе 0,2...0,3 мл или 13...14-дневкым КО внутривенно в дозе 0,1...0,2 мл, Каждым материалом заражают не менее 5 эмбрионов.
3.3.2. Зараженные куриные эмбрионы помещают в термостат при 33,бЧ; и выдерживают в течение 5 дней. В этот период эмбрионы овоскопируют два раза в сутки. Куриные эмбрионы, погибшие в течение первых 24 ч, уничтожают (неспецифическая гибель), остальные эмбрионы после гибели и все оставшиеся живыми на б-е сутки после заражения охлаждают в холодильнике 2„.4ч при 2...4°С, затем их вскрывают и исследуют зародыш на наличие макроскопических изменений. Характерными для возбудителя катаральной лихорадки является вишнево-красная окраска погибших куриных эмбрионов с многочисленными кровоизлияниями на голове и туловище.
3.3.3. Для идентификации выделенного вируса готовят 10% -ную суспензию из эмбрионов (без головы) и заражают клеточные культуры (см. л. 3.2-5).
3.3.4. При сохранении жизнеспособности эмбрионов или отсутствии характерных изменений у погибших проводят два последовательных пассажа на КЭ, используя 10% -ную суспензию (см. п, 3.3.3).
112 Лвборатиркоя дшмиктиха еиррсных бслеиней хиьотных
МК1М1Ы1ШП*иЛ1Д1а(1 1МГ| НИ'в( •« НЫМ« Ml Ш ■ AM МС Mi Mill. IWaMMMnMV В1ЩМТЯ Ь«Л1|Г|1 Ш: мм I MHI
3.4. Идентификация вируса.
3.4.1. Для идентификации вируса пользуются прямым и непрямым методом иммунофлуоресценции.
3.4.2. При прямом методе на стеклянные пластинки (стеклышки) с зараженной культурой клеток наносят специфическую флуоресцирующую сыворотку в рабочем разведении. Препараты помещают во влажную камеру на 30 мин при 37°С* затем их промывают в двух сменах фосфатного буферного раствора по 10 мин.
В качестве контроля окрашивают стеклышки с незара-лсонной культурой клеток.
3.4.3. При непрямом методе на стеклышки с зараженной культурой клеток наносят специфическую (немеченую) сыворотку катаральной лихорадки в рабочем разведении. Для контроля на часть препаратов наносят нормальную сыворотку овцы.
Препараты помещают во влажную камеру и выдерживают в термостате 30 мин при 37°С, затем дважды их промывают физиологическим раствором (pH 7,2...7,4) по 10 мин и после подсушивания наносят антивидовую флуоресцирующую сыворотку в рабочем разведении. Окрашивают их во влажной камере 30 мин при 37°С, После промывания препаратов в двух сменах фосфатного буферного раствора (pH 7,2...7,4) их подсушивают и просматривают в люминесцентном микроскопе.
3.4.4. При положительном результате в препаратах обнаруживают ярко светящиеся зелено-желтым цветом гранулы, конгломераты в цитоплазме и перинуклеарнон зоне или такой же интенсивности диффузное свечение всей или большей части цитоплазмы.
В контрольных препаратах аналогичное свечение должно отсутствовать.
3.4.5. Метод иммунофлуоресценции является группо-специфическим и им может быть идентифицирован любой возбудитель из 23 серологических актигенкых вариантов.
Для окончательного установления типа возбудителя применяют реакцию нейтрализации (во ВНИИВВиМ).
4. Биологическое исследование.