Методические указания по установлению и обоснованию гигиенических нормативов содержания химических примесей, биологических агентов в пищевой продукции по критериям риска для здоровья человека
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Документ разработан в целях унификации исходной информации, способов ее обработки и методического обеспечения процедуры разработки новых и планового пересмотра существующих гигиенических нормативов содержания химических примесей, биологических агентов в пищевой продукции по критериям риска для здоровья человека, включенных в Единые санитарно-эпидемиологические и гигиенические требования к продукции (товарам), подлежащей санитарно-эпидемиологическому надзору (контролю), и технические регламенты Таможенного союза (Евразийского экономического союза).
Оглавление
2 Общие положения
3 Выбор релевантной информации для установления гигиенических нормативов содержания химических примесей, биологических агентов в пищевой продукции по критериям риска.
4 Требования к проведению токсикологических экспериментов и необходимого набора тестов и методик проведения токсикологических экспериментов для обоснования ДСД/УПП
5 Требования к проведению экспериментов и необходимого набора методик проведения экспериментов для обоснования гигиенических нормативов содержания биологических агентов в пищевой продукции по критериям риска здоровью человека
6 Требования к проведению эпидемиологических исследований для обоснования гигиенических нормативов содержания химических примесей биологических агентов в пищевой продукции по критериям риска здоровью человека и его эволюции
7 Установление максимально допустимых уровней содержания химических примесей и биологических агентов в пищевой продукции.
8 Верификация ДСД/УПП, химических веществ, поступающих с пищевой продукцией, и уровней экспозиции биологических агентов, соответствующих приемлемому риску, с использованием методологии оценки рисков здоровью населения при воздействии химических и биологических факторов для определения показателей безопасности продукции (товаров)
9 Определение объема потребления пищевой продукции для расчета МДУ
10 Определение максимально допустимых уровней (МДУ) химических примесей и биологических агентов в пищевой продукции.
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2021 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
| 26.02.2020 | Утвержден | Евразийская экономическая комиссия | 4 |
|---|
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5
стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24

стр. 25

стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
МЕТОДИЧЕСКИЕ УКАЗАНИЯ по установлению и обоснованию гигиенических нормативов
содержания химических примесей, биологических агентов в пищевой продукции но критериям риска для здоровья человека
1. Настоящий документ разработан в целях унификации исходной информации, способов ее обработки и методического обеспечения процедуры разработки новых и планового пересмотра существующих гигиенических нормативов содержания химических примесей, биологических агентов в пищевой продукции по критериям риска для здоровья человека, включенных в Единые санитарно-эпидемиологические и гигиенические требования к продукции (товарам), подлежащей санитарно-эпидемиологическому надзору (контролю), и технические регламенты Таможенного союза (Евразийского экономического союза).
Установление максимально допустимых уровней пестицидов осуществляется с учетом данных согласно подразделу 4 «Критерии оценки безопасности пестицидов и их действующих веществ» раздела 15 «Требования к пестицидам и агрохимикатам» Единых санитарно-эпидемиологических и гигиенических требований к продукции (товарам), подлежащей санитарно-эпидемиологическому надзору (контролю), и в соответствии с законодательством государства - члена Евразийского экономического союза.
2. Общие положения.
2.1. Установление по итогам разработки или пересмотра гигиенических нормативов содержания химических примесей, биологических агентов в пищевой продукции по критериям риска и его эволюции производится с соблюдением следующих принципов:
- приоритет безопасности, сохранения здоровья над любыми другими элементами качества жизни - один из ключевых принципов как системы гигиенического нормирования, так и методологии анализа риска здоровью;
- научное обоснование методов и критериев - оценка риска должна основываться на всех доступных научных данных, количественная информация должна быть использована в максимально возможной степени;
- использование всей релевантной информации предполагает необходимость проведения максимально полного использования данных, в том числе содержащихся в международно признанных источниках и базах данных с приоритетом результатов эпидемиологических исследований;
- реалистичность сценариев экспозиции - формирование сценариев, отражающих в максимальной степени сложившуюся ситуацию, позволяющих избежать как недооценки, так и переоценки риска. В то же время должны рассматриваться сценарии, учитывающие особенности групп населения с высокой чувствительностью и наиболее подверженных риску;
- этапность процедуры - оценка риска должна предусматривать четыре стадии оценки риска (идентификацию опасности, оценку зависимости «экспозиция - эффект (ответ)» (характеристику опасности), оценку воздействия (экспозиции) и характеристику риска);
- транспарентность оценки риска - описание всех процедур, исходных и промежуточных данных, результатов оценки риска, а также логическое обоснование, логика развития, ограничивающие факторы, исходные допущения, оценочные суждения, решения, недостатки и неопределенности представленного заключения полностью
- изучение цитируемости и рейтинга источников информации;
- анализ статуса источника, рецензентов;
- проверка актуальности и обновляемое™ источника;
- оценка наличия математической постановки или ссылок на нее;
- оценки обоснованности применяемых методов обработки данных;
- обоснования вида и выбора моделей;
- оценка массива данных;
- проверка наличия результатов оригинальных исследований;
- проверка наличия результатов первичных данных и статистической обработки результатов;
- проверка наличия количественных характеристик экспозиции и эффектов (ответов);
- проверка наличия сведений о контингентах риска.
Таким образом, источник информации является релевантным при соответствии этим критериям.
4. Требования к проведению токсикологических экспериментов и необходимого набора тестов и методик проведения токсикологических экспериментов для обоснования ДСД/УПП, что необходимо для установления гигиенических нормативов содержания химических примесей в пищевой продукции по критериям риска здоровью человека и его эволюции.
4.1. Алгоритм изучения токсикологических профилей идентифицированных в пищевой продукции веществ, содержащихся в химических примесях.
Аналитическо-информационный поиск об исследуемом веществе, включающий сведения о составе и химическом строении, физикохимических свойствах, результатах токсикологических испытаний
in vivo и in vitro, токсикологические данные о структурно родственных (подобных) веществах, позволяет определить перечень необходимых для проведения токсикологических экспериментов и способствует выбору адекватных доз (таблица 1).
Таблица 1
Алгоритм анализа результатов информационного поиска данных о чужеродных химических веществах в составе пищевой продукции
| ||
|
Физико-химическая характеристика |
|
Наименование вещества |
синонимы |
|
Химический класс |
Определяется химический класс, к которому относится соединение, что необходимо для оценки возможной токсичности вещества по сравнению с его химическими аналогами и планирования объема дальнейших экспериментальных исследований |
|
Область применения |
Необходимо для определения возможных путей поступления химического вещества |
|
Назначение вещества |
Необходимо для определения видов пищевой продукции, являющихся приоритетными источниками |
|
Эмпирическая и структурная формула |
Анализ структуры вещества позволяет сделать предварительные выводы о токсичности вещества Анализ молекулярной массы в гомологическом ряду позволяет прогнозировать токсичность вещества, при |
|
Молекулярная масса |
котором с увеличением его молекулярного веса возрастает токсичность, т е. каждый последующий член гомологического ряда токсичнее предыдущего |
|
Пути поступления в среду обитания |
Позволяет определить группы пищевой продукции, являющиеся потенциальными источниками химического вещества в рационе |
|
2 Физико-химические показатели | ||||||||
|
|
3. Токсиколого-гигиеническая характеристика | ||
|
|
наблюдения за животными - 14 суток), выражается в миллиграммах вещества на 1 килограмм массы животного (мг/кг) | |
|
DL*) дермально |
Доза вещества, вызывающая гибель 50% животных при однократном эпикутанном нанесении (срок наблюдения за животными - 14 суток), выражается в миллиграммах вещества на 1 килограмм массы животного (мг/кг) |
|
CL$o инфляционно |
Вызывает гибель 50% животных при ингаляционном воздействии в течение двух часов для мышей и четырех часов для крыс (срок наблюдения за животными - 14 суток), выражается в миллиграммах вещества на 1 метр кубический воздуха (мг/м3) |
|
Раздражающее действие на кожу и слизистые оболочки глаза |
Способность вещества в условиях однократного или повторного воздействия оказывать раздражающее действие на кожные покровы или слизистые |
|
Субхроническая и хроническая токсичность |
Неблагоприятные эффекты, установленные в субхронических и хронических экспериментах |
|
Специфические и отдаленные эффекты в тестах in vivo и in vitro (аллергенность, тератоген ноет ь, эмбриотоксичность, репродуктивная токсичность, мутагенность, канцерогенность) |
Специфические и отдаленные эффекты, установленные в тестах in vivo и in vitro |
|
Гигиеннческие нормативы в различных объектах среды обитания: воздух рабочей зоны, атмосферный воздух, питьевая вода, уровень загрязнения кожных покровов |
Необходимы для учета поступления в организм вещества с учетом различных путей |
Для идентификации и характеристики химических контаминантов целесообразно использовать данные из профилей опасностей (токсикологических профилей), приведенных в базах данных и информационных ресурсах, включающих информацию о физикохимических свойствах и токсиколого-гигиенической характеристики веществ (таблица 2).
Таблица 2
Перечень наиболее распространенных баз данных и информационно-поисковых ресурсов для токсикологической оценки химических контаминантов
|
№ |
Наименование и краткое описание ресурса |
Ссылка |
|
1 |
Федеральный регистр потенциально опасных хим. и бнол. веществ. Включает общую информацию о химическом веществе: идентификационные данные, область применения, агрегатное состояние, форму выпуска, СИЗ, клиническую картину острого отравления, наиболее поражаемые органы и системы, раздражающее действие на кожу и глаза и первую помощь при отравлениях |
http://www.rpohv.ru/online/ |
|
2 |
GENE-TOX - база данных с информацией о мутагенности химических веществ. Входит в TOXNET Databases |
httpsV/toxnet.nIm.nih.gov/n ewtoxnet/genetox.htm |
|
3 |
Ваза данных Объединенного исследовательского центра ЕС веществ, обладающих канцерогенным и/или мутагенным потенциалом |
https://eurl-ecvam.irc.ec euroDa eu/data bases/genotoxicitv-carcinogenicitv-db |
|
4 |
База данных свойств химических веществ GESTIS |
http://gestis-en itrust de/ |
|
5 |
Банк данных свойств опасных веществ HSDB (Hazardous Substances Data Вапк). включает обширную информацию о свойствах химических веществ, в том числе данные по токсикологии, экотоксикологии, отдаленных последствиях, физико-химических свойствах, воздействии на человека и др. Входит в TOXNET Databases |
https://toxnct.nlm.nih.gov/ |
|
6 |
ChemlDplus - база данных химических веществ с указанием их наименования, синонимов, структуры (в т.ч. 3D), сведений по токсичности и физикохимических свойств. Входит в TOXNET Databases |
https://chcm.nlm.nih.gov/ch emidplus/ |
|
7 |
База данных Международного агентства по изучению рака (МАИР) |
https://monographs.iarc.fr/a gents-classified-by-the-iarc/ |
|
8 |
База данных по канцерогенностн Carcinogenic Potency Database (CPDB) Содержит резюме с результатами испытаний, в том числе на органы-мишени |
https://toxnet.nlm.nih.gOv/n ewtoxnet/cpdb htm |
|
Поисковые системы | ||
|
9 |
TOXNET Databases (Национальная медицинская библиотека США) - ресурс по поиску баз данных по токсикологии, опасным химическим веществам, воздействию на здоровье и выбросам токсичных веществ Осуществляется поиск по следующим ресурсам: HSDB, TOXLINE, ChemlDplus, LactMed, DART, ТОХМАР, TRI, CTD, Household Products Database, Haz-Map, IRiS, ITER, ALTBIB, CCRIS, CPDB, GENE-TOX |
https://toxnet.nlm nih gov/ |
|
10 |
Информация о безопасности химических веществ от межправительственных организаций INCH ЕМ. Осуществляется поиск по следующим ресурсам: Concise International Chemical, Concise International |
http://www.inchem.org/ |
|
Chemical Assessment Document (CICADS). Environmental Health Criteria (EHC) monographs,Harmonization Project Publications, Health and Safety Guides (HSGs), International Agency for Research on Cancer (IARC) - Summaries and Evaluations, International Chemical Safety Cards (ICSCs), IPCS/CFC Evaluation of Antidotes Series.Joint Expert Committee on Food Additives (JECFA), Monographs and evaluations. Joint Meeting on Pesticide Residues (JMPR) -Monographs and evaluations, Keml-Riskline, Poisons Information Monographs (PIMs). Screening Information Data Set (SIDS) for High Production Volume Chemicals, UK Poison Information Documents (UKPID) | ||
|
и |
Портал ChemAgora Объединенного исследовательского центра Европейского союза. Осуществляется поиск по следующим ресурсам: NCI/CADD Chemical Identifier Resolver, PubChem's PUG REST Service, ChEMBL Data Web Services, Ketcher, eChemPortal, ChEMBL, ChEBl, ChemSpider, PubChem, ToxNet, ConsensusPathDB, CompTox Chemistry, Comparative Toxicogenomics Database (CTDbase). Common Chemistry; CREST; AOP Wiki |
http://chemagora.jrc.ec.euro pa. eu/chem agora/ |
Могут использоваться иные источники информации, надежность и достоверность данных в которых должна быть подтверждена ссылками на опубликованные источники.
В базах данных может быть получена дополнительная информация, которая необходима для оценки риска здоровью, ассоциированного с химическими веществами - NOAEL, LOAEL, Benchmark Dose (BMD), угол (фактор) наклона при пероральном поступлении (Slope Factor, SFo).
4.2. Изучение общетоксического действия.
Изучение общетоксического действия вещества позволяет определить зависимость «доза - ответ» и «время - ответ» и сопоставить связь между воздействующей дозой исследуемого химического вещества и токсическими эффектами.
Токсикологические эксперименты проводятся на лабораторных животных (грызунах - линейных/нелинейных белых крысах и/или
мышах, и/или животных, не являющихся грызунами), которые являются наиболее чувствительными к воздействию вещества по результатам аналитическо-информационного поиска. Исследование контаминанта на лабораторных животных, не являющихся грызунами, должно быть детально обосновано.
Изучение общетоксического действия включает определение острой, подострой, субхронической и хронической токсичности. Длительность токсикологического эксперимента определяется в зависимости от физико-химических свойств и токсикологической оценки химического вещества.
4.2.1. Изучение общетоксического действия на грызунах. Определение острой токсичности.
Используются экспериментальные животные обоего пола (мыши и/или крысы). Для выяснения возможных различий в половой резистентности животных к изучаемому веществу формируются равновеликие экспериментальные группы самцов и самок. При выявлении в процессе эксперимента тенденции к увеличению смертности особей одного пола суммарно во всех группах более чем на 20%, то различия считают существенными. В таком случае проводят дополнительные исследования по установлению параметров острой токсичности вещества отдельно для самок и самцов.
Число животных в группе должно быть не менее 6, путь введения: пероральный и парентеральный. Используется 4-5 доз, достаточных для расчета DLso (интервал между дозами зависит от используемого в дальнейшем метода статистического расчета); если вещество обладает малой токсичностью, то следует ввести максимально возможную дозу при изучении острой токсичности с учетом технических возможностей. Если вещество находится в растворителе/носителе, то проводится
исследование острой токсичности растворителя/носителя (если не известны их токсикологические характеристики). Частота введения -однократно, период наблюдения за животными 14 суток. Среднесмертельная доза DL50 рассчитывается общепринятыми методами, например, пробит-анализом.
Экспериментальная программа: ежедневное наблюдение общего состояния, взвешивание животных 3 раза в течение периода наблюдения, вскрытие павших животных и всех выживших в конце эксперимента, макроскопическое описание, определение относительной массы органов и изучение гистологической структуры органов с выраженными макроскопическими изменениями.
4.2.2. Изучение подострой и субхронической токсичности.
Эксперимент проводится на одном виде взрослых животных обоего пола. Число животных в группе не менее чем по 10 особей обоего пола. Основной путь введения внутрижелудочный, используется три дозы с обязательным формированием контрольных групп самок и самцов; меньшая из исследуемых доз не должна вызывать интоксикацию животных, максимальная может вызывать признаки интоксикации у животных, средняя выбирается между ними (обычно используются 1/5 - 1/20 от установленной в исследованиях LD*,). Продолжительность введения вещества лабораторным животным -ежедневно в течение всего эксперимента. В случае, если для введения вещества требуется растворитель, то, наряду с интактным контролем, необходим контроль, получающий соответствующий растворитель.
Экспериментальная программа: ежедневная регистрация общего состояния, взвешивание 1 раз в неделю. До введения вещества и в течение эксперимента проводятся гематологические.
биохимические, физиологические исследования, анализ мочи, а при необходимости дополнительные исследования.
Погибшие в течение эксперимента животные подлежат вскрытию, макроскопическому описанию, органы взвешиваются и подвергаются гистологическому исследованию. По окончании опыта все животные в каждой группе подвергаются вскрытию, макроскопическому описанию, внутренние органы взвешиваются.
По завершении эксперимента проводятся гематологические и биохимические исследования. Гистологическому исследованию подвергаются, как правило, все контрольные животные и те, которые подвергались воздействию наибольшей дозы вещества. Внутренние органы животных остальных групп подвергаются гистологическому исследованию только при наличии в них макроскопических изменений.
4.2.3. Изучение хронической токсичности.
Используется один наиболее чувствительный вид животных с учетом их половой резистентности. Число животных в каждой группе должно быть не менее чем 20, путь введения внутрижелудочный, продолжительность введения составляет до 12 месяцев и более (при наличии существенной кумуляции или отнесении к высокотоксичным по LD5(, веществам) при ежедневном введении.
В случае, если для введения вещества требуется растворитель, то, наряду с интактным контролем, необходим контроль, получающий соответствующий растворитель.
Выбор изучаемых доз в хроническом эксперименте базируется на результатах изучения острой, подострой и субхронической токсичности изучаемого химического вещества. Используется три дозы вещества с обязательным формированием контрольной группы: как правило, меньшая из исследуемых доз не должна вызывать
интоксикацию животных, максимальная может вызывать признаки интоксикации животных, средняя выбирается между ними.
Экспериментальная программа включает интегральные тесты, исследования мочи, гематологические, биохимические и физиологические исследования. а при необходимости дополнительные исследования (например, нагрузочные пробы).
Интегральные тесты: прирост массы тела, потребление пищи, общее поведение, осмотр, ректальная температура и иные тесты.
Физиологические исследования: тест «открытое поле», суммация подпороговых импульсов, электрокардиография и др.
Гематологические исследования: показатель гематокрита,
гемоглобин, количество эритроцитов, цветовой показатель, скорость оседания эритроцитов, средний объем эритроцитов, количество лейкоцитов, лейкограмма, тромбоциты, ретикулоциты, миелограмма и иные.
Биохимические исследования сыворотки крови: аспартатам и нотрансам и наза, алан и нам и нотрансам и наза,
лактатдегидрогеназа, билирубин, глюкоза, натрий, калий, общий белок, мочевина, креатинин, щелочная фосфатаза, общие липиды, общий холестерин и иные, а также, при необходимости, изучение биохимических показателей органов (система ферментов метаболизма ксенобиотиков, стабильность мембран лизосом клеток печени, система регуляции апоптоза, система антиоксидантной защиты, воспалительной реакции и др ).
Исследование мочи: суточный диурез, pH мочи, белок, билирубин, сахар, мочевина, натрий, калий и иные.
Возможно использовать нагрузочные пробы: бромсульфалеиновая проба, длительность «гексеналового сна», оценка секреторной функции почек по экскреции фенолового красного и др.
Общее состояние всех животных регистрируется ежедневно; взвешивание проводится 1 раз в неделю в первые 3 месяца эксперимента, затем - 1 раз в месяц; потребление пищи каждым животным или группой должно измеряться 1 раз в неделю; у части животных каждой группы необходимо провести анализ мочи, гематологические, биохимические и физиологические исследования, а при необходимости дополнительные исследования.
После прекращения введения вещества часть животных оставляется для изучения в восстановительный период (не менее 30 суток в случае, если не предусматривается изучение хронической токсичности в течение всей жизни экспериментальных животных), если установлены функциональные изменения; остальные животные подвергаются вскрытию, макроскопическому описанию, органы взвешиваются. Гистологическому исследованию подвергаются внутренние органы животных с макроскопическими изменениями.
4.2.4. Изучение общетоксического действия на лабораторных животных, не являющихся грызунами. Определение острой токсичности.
Используется один вид животных. Число животных в группе должно быть не менее двух, путь введения внутрижелудочный. Изучаются две дозы для ориентировочного определения летальной дозы. Частота введения - однократно, длительность наблюдения 14 суток.
Экспериментальная программа: ежедневное наблюдение за общим состоянием, взвешивание не менее трех раз за период наблюдения.
и систематически констатируются, документируются и доступны для ознакомления;
- доку ментальное оформление процедуры и результатов -итоговый документ по оценке риска должен содержать указания на любые ограничения, неопределенности, допущения и их влияние на оценку риска. Заключение по оценке риска следует представлять в форме, легкой для понимания лиц, принимающих решение по управлению риском;
- пересмотр результатов оценки риска здоровью в свете вновь полученных научных данных - основанием для пересмотра могут служить сведения из релевантных источников об обосновании новых параметров для оценки риска здоровью (референтных уровнях факторов опасности, моделях зависимости «экспозиция - эффект», существенных уточнениях сценариев экспозиции и пр), научно обоснованном включении/исключении дополнительных факторов риска.
2.2. Гигиенические нормативы содержания химических примесей, биологических агентов в пищевой продукции по критериям риска устанавливаются для отдельных групп (или отдельных видов) пищевой продукции.
2.3. Гигиенические нормативы содержания химических примесей, биологических агентов в пищевой продукции должны обеспечивать безопасность (отсутствие недопустимого (неприемлемого) риска) для здоровья человека при разумном потреблении пищевой продукции.
2.4. Методические подходы к установлению гигиенических нормативов содержания химических примесей, биологических агентов в пищевой продукции не должны противоречить основным международным документам («Рабочие принципы проведения анализа риска в области безопасности продуктов питания для применения
лабораторные исследования по мере необходимости, в конце периода наблюдения или после гибели все животные каждой группы вскрываются, описываются макроскопически, органы взвешиваются, при необходимости подвергаются гистологическому исследованию.
Изучение подострой и субхронической токсичности проводится по следующей схеме. Используется один вид животных с числом особей не менее трех в группе каждого пола. Путь введения внутрижелудочный, изучаются три дозы вещества. Срок введения составляет от 28 дней и до 90 дней при ежедневном введении.
Обязательно формирование интактной группы; при использовании растворителей/носителей необходима дополнительная контрольная группа с введением вышеназванного компонента.
Экспериментальная программа: ежедневное наблюдение за общим состоянием; взвешивание и контроль потребления пищи 1 раз в неделю; гематологические, биохимические, физиологические исследования по мере необходимости проводятся у всех животных в каждой группе.
Погибшие животные подлежат вскрытию, макроскопическому обследованию, органы взвешиваются и исследуются гистологически.
В конце эксперимента у животных проводятся гематологические, биохимические исследования, анализ мочи, при необходимости и другие лабораторные исследования. Эксперимент завершает макроскопическое обследование, взвешивание, гистологическое изучение органов.
4.2.5. Изучение хронической токсичности.
Используются животные одного вида обоего пола. Количество животных не менее, чем по четыре обоего пола в каждой группе. Путь введения внутрижелудочный, изучаются три дозы и контроль для животных обоего пола. Контрольная группа: интактный контроль
правительствами. CAC/GL 62-2007», Директива 2001/95/ЕС об общей безопасности продукции. Регламент ЕС 2002/178/ЕС об общих принципах и требованиях пищевого права и установлении процедур в области безопасности пищи) и методологии, рекомендованной Евразийской экономической комиссией (Методология оценки рисков здоровью населения при воздействии химических, физических и биологических факторов для определения показателей безопасности продукции (товаров)/ Евразийская экономическая комиссия. - М.: Книжный формат, 2014. - 115 с ).
2.5. До установления уровней допустимого риска загрязнителей пищевой продукции для здоровья человека в качестве критерия безопасности используются уровни приемлемого риска здоровью.
2.6. При установлении гигиенических нормативов содержания
химических примесей, биологических агентов в пищевой продукции результаты оценки риска, выполненные по результатам
эпидемиологических исследований, рассматриваются как
приоритетные.
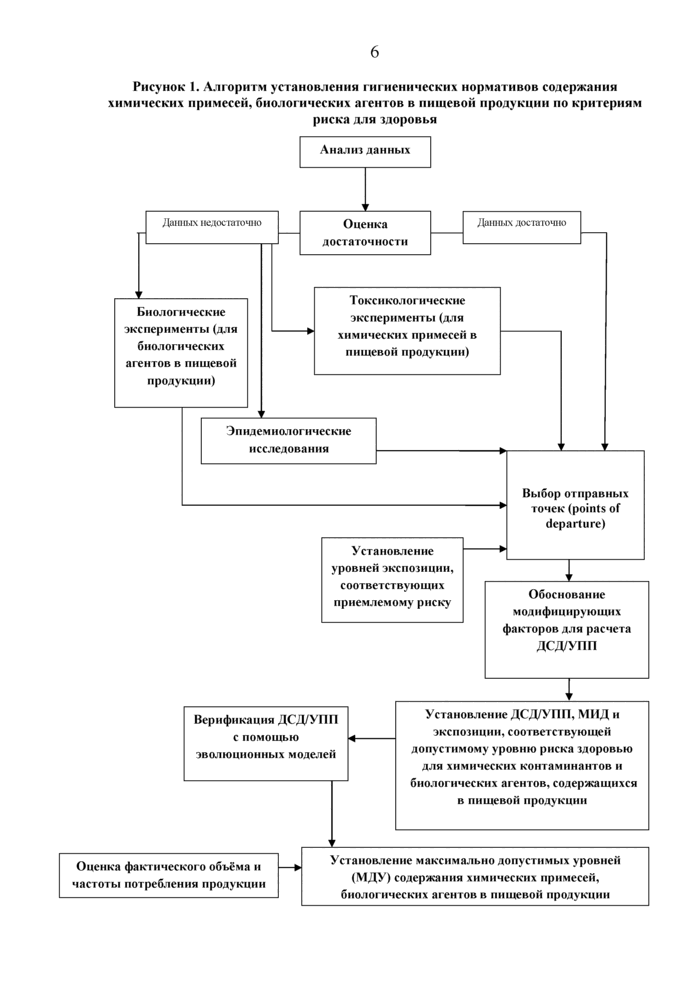
2.7. Установление гигиенических нормативов содержания химических примесей, биологических агентов в пищевой продукции по критериям риска для здоровья производится при помощи последовательного выполнения следующих действий (рисунок 1):
- сбор и анализ информации о результатах проведенных ранее исследований по оценке воздействия содержания химических примесей и/или биологических агентов в пищевой продуции на здоровье человека;
- при недостаточности информации, необходимой для установления допустимой суточной дозы (далее - ДСД)/уровня условно
переносимого потребления (далее - УПП) - проведение лабораторных и/или эпидемиологических исследований;
- выбор отправных точек и обоснование модифицирующих факторов для расчета ДСД;
- установление ДСД и, для химических веществ, способных накапливаться в организме, УПП и/или уровней экспозиции, соответствующих приемлемому риску;
- верификация ДСД/УПП химических контаминантов и биологических агентов в пищевой продукции с помощью эволюционных моделей;
- оценка фактического объема и частоты потребления пищевой продукции;
- установление максимально допустимых уровней (далее - МДУ) содержания химических примесей, биологических агентов в пищевой продукции.
|
Рисунок 1. Алгоритм установлении гигиенических нормативов содержании химических примесей, биологических агентов в нишевой продукции но крнгерним риска дли здоровий |
2.8. Пересмотр гигиенических нормативов содержания химических примесей, биологических агентов в пищевой продукции осуществляется при обосновании новых параметров для оценки риска здоровью и научно обоснованном включении/исключении дополнительных факторов риска, а также в связи с существенным изменением потребления отдельных групп (или отдельных видов) пищевой продукции.
2.9. Если по результатам токсиколого-гигиенической оценки и идентификации опасности для здоровья выявлена низкая токсичность химических примесей или низкая вирулентность биологических агентов и их незначительный уровень потребления с пищевой продукцией, может быть принято решение о нецелесообразности разработки такого гигиенического норматива по критериям риска здоровью.
3. Выбор релевантной информации для установления гигиенических нормативов содержания химических примесей, биологических агентов в пищевой продукции по критериям риска.
При выборе релевантной информации применяется система критериев:
- адекватность источников информации (рецензирование, документирован ность);
- достоверность (подтверждение из других источников, корректные методы математической обработки и пр );
- описание условий получения информации (обзор, эксперимент, эпидемиологическое исследование);
- наличие количественных характеристик экспозиции и эффектов (ответов);
- наличие сведений о контингентах риска.
3.1. Оценка адекватности источников информации производится в зависимости от вида информации: документированная на бумажных и электронных носителях и недокументированная (базы данных).
Оценка релевантности источников документированной информации осуществляется по показателям наличия рецензирования и необходимых реквизитов.
Источник документированной информации признается адекватным, если включен в общепризнанные системы цитирования, предполагающие обязательное рецензирование публикуемой информации (например, Web of Science, Scopus, РИНЦ и пр). Дополнительным показателем адекватности может служить наличие необходимых реквизитов (например. DOI для печатных изданий, регистрационный номер для нормативно-правовых документов).
Для недокументированных источников (базы данных) показателем их адекватности будет являться принадлежность к международным и национальным государственным структурам (например. Всемирной организации здравоохранения (ВОЗ), Комиссии Кодекс Алиментариус, Агентству по охране окружающей среды США и пр ). Признаком адекватности недокументированных источников является также включение их в перечень источников информации, рекомендуемых для использования при оценке риска здоровью национальными органами государственного управления.
3.2. Источник информации считается достоверным, если методы математической обработки соответствуют массиву исходных данных и его характеристикам (объему, распределению). Признаками достоверности источника являются также результаты оценки обоснованности применяемых методов обработки данных, наличия математической постановки или ссылок на нее, обоснования вида
и выбора моделей, оценка массива данных. Для установления корректности методов математической обработки данных требуется оценка результатов статистической обработки экспериментальных данных, (определение среднего арифметического, дисперсии, моды и медианы и пр ). Подтверждение аналогичной информации из других источников (не менее двух) является одним из дополнительных важных признаков достоверности.
Кроме того, оценка достоверности источников информации проводится с помощью определения статуса ученого и его репутации в научном мире. Статус ученого определяется характеристиками: научная степень, звание, премии и награды, индекс цитируемое™.
3.3. Источник информации признается адекватным, если в нем присутствует информация об условиях ее получения. Если источник носит характер научного обзора, признаком его адекватности является наличие ссылок на другие релевантные источники информации, обобщения опубликованных результатов оригинальных исследований. Если источник содержит результаты оригинальных исследований, в нем должна быть приведена полная информация о цели этих исследований, количественное описание условий их проведения, первичных данных и статистической обработки результатов.
3.4. Для задач установления гигиенических нормативов содержания химических примесей, биологических агентов в пищевой продукции по критериям риска важным критерием релевантности информации является наличие количественных характеристик экспозиции и эффектов (ответов) со стороны здоровья на эту экспозицию.
Как правило, количественной характеристикой экспозиции является доза химических примесей и отдельных биологических
агентов. В качестве количественной характеристики экспозиции биологических агентов, для которых не установлена зависимость величины ответа от количества микроорганизмов и/или дозы токсинов рассматривается вероятность потребления контаминированной пищевой продукции. Количественной характеристикой эффекта химических примесей следует считать негативное изменение клинико-лабораторных показателей, а ответа - распространенность нарушений здоровья в виде заболеваний, их симптомов или результатов клинико-лабораторных показателей, свидетельствующих о нарушении функций организма. В отношении ответов на воздействие биологических агентов количественной характеристикой является распространенность инфекционных и паразитарных заболеваний.
3.5. Для задач установления гигиенических нормативов содержания химических примесей, биологических агентов в пищевой продукции по критериям риска еще одним важным критерием релевантности информации является наличие сведений о контингентах риска. В качестве контингентов риска могут быть выделены группы с наибольшим потреблением отдельных групп (или отдельных видов) пищевой продукции, наиболее чувствительные к воздействию химических примесей и биологических агентов субпопуляции населения (дети, беременные и кормящие женщины, лица с иммунными нарушениями и др.).
Для этих контингентов должны быть отдельно выделены количественные характеристики экспозиции с описанием ее сценария и эффектов с расшифровкой их содержания при различных уровнях экспозиции.
Для обоснования источников информации производятся следующие действия: