Методические рекомендации 2121-80
Постановка исследований по гигиеническому нормированию промышленных аллергенов в воздухе рабочей зоны
Купить Методические рекомендации 2121-80 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Методические рекомендации рассчитаны на врачей-токсикологов НИИ гигиенического профиля и ведомственных токсикологических лабораторий, занимающихся обоснованием санитарных стандартов вредных веществ в воздухе рабочей зоны
Оглавление
Введение
Схема постановки опытов
1. Постановка опытов по выявлению сенсибилизирующих свойств изучаемых соединений, полимерных и сложных продуктов
2. Постановка опытов по определению опасности развития сенсибилизации при поступлении аллергена через кожу и органы дыхания
3. Оценка опасности химического аллергена и рекомендации к установлению ПДК
4. Методы выявления сенсибилизации
4.1. Приготовление рабочих доз и концентраций аллергенов
4.2. Постановка капельной кожной пробы
4.3. Постановка внутрикожной пробы
4.4. Постановка конъюнктивальной пробы
4.5. Постановка РСЛЛ
4.6. Постановка РСАЛ
4.7. Постановка тестов повреждения (ППН) и альтерации (ТАН) нейтрофалов
4.8. Постановка реакции специфической микропреципитации (РСМП)
Приложение 1 к Положению о порядке внедрения достижений медицинской науки в практику здравоохранения. Отрывной лист учета использованных методов профилактики, диагностики и лечения
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
| 22.01.1980 | Принят | Первый заместитель председателя УМСа Министерства здравоохранения СССР | |
|---|---|---|---|
| 23.01.1980 | Утвержден | Заместитель Главного государственного санитарного врача CCCР | 2121-80 |
| Разработан | НИИ резиновых и латексных изделий | ||
| Разработан | ВНИИ железнодорожной гигиены | ||
| Разработан | НИИ гигиены труда и профзаболеваний АМН СССР | ||
| Издан | Минздрав ЛатвССР | 1980 г. | |
| Разработан | ВНИИ антибиотиков | ||
| Разработан | Рижский мединститут |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4
стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ СССР ГЛАВНОЕ САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКОЕ УПРАВЛЕНИЕ
Согласовано Первый заместитель председателя УМСа Министерства здравоохранения СССР А. С. ЕРМОЛАЕВ
22.01.1980
Утверждаю Заместитель Главного Государственного санитарного врача СССР А. И. ЗАЙЧЕНКО
№ 2121-80 от 23.01.1980
Постановка исследований по гигиеническому нормированию промышленных аллергенов в воздухе рабочей зоны
Методические рекомендации
М3 ЛатвССР
Рига
1980
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ СССР ГЛАВНОЕ САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКОЕ УПРАВЛЕНИЕ
ПОСТАНОВКА ИССЛЕДОВАНИЙ ПО ГИГИЕНИЧЕСКОМУ НОРМИРОВАНИЮ ПРОМЫШЛЕННЫХ АЛЛЕРГЕНОВ В ВОЗДУХЕ РАБОЧЕЙ ЗОНЫ
Методические рекомендации
М3 ЛатвССР — Рига — 1980
Стьюдента (t). При сравнении числа сенсибилизированных животных в нескольких опытных группах или таковых с контрольными применяют непараметрические методы (например, критерий X). Следует иметь в виду, что на уровне Limaz отличия среднегрупповых показателей и частоты сенсибилизации могут достоверно не отличаться от данных параллельного контроля, в связи с чем на данном уровне вычисление достоверности нецелесообразно.
При оценке неспецифических показателей сенсибилизации, поскольку они в отличие от аллергических реакций не являются качественно новыми для сенсибилизированного организма, а лишь представляют изменение уровня физиологической реакции, как и при оценке показателей токсического действия применяют метод «двух сигм».
4.1. Приготовление рабочих доз и концентраций аллергенов
Поскольку аллергические провокационные пробы и лабораторные иммунологические реакции и тесты основаны на взаимодействии молекулы аллергена с антителами и рецепторами Т- и В-лимфоцитов в физиологических жидкостях, при выявлении сенсибилизации применяют водорастворимые препараты аллергенов.
Для белковых, полисахаридных и водорастворимых химических аллергенов в качестве растворителя применяют физиологический раствор. При этом следует иметь в виду, что величина рабочей дозы, как правило, измеряется в мгк и, следовательно, достаточна растворимость в пределах 0,1—0,01%- Для водонерастворимых химических аллергенов подбирают водорастворимое соединение, имеющее групповую гаптенную детерминанту (например, для всех полимеров на основе формальдегида — формальдегид, для нитросоединений — нитрит натрия, для эпоксидных полимеров — эпихлоргидрин и т. д.). Из отвержденных полимеров приготавливают водные вытяжки.
Исключение составляют растворы для эпнкутанных проб, которые удобнее делать с летучими иидиферентными для кожи растворителями (ацетон, этиловый спирт) или мазевыми основами (вазелин, ланолин), и для внутрикожных проб, при постановке которых допустимо применение масел.
Рабочие дозы следует приготавливать из химически чистых веществ и следить, чтобы pH раствора было нейтральным или слабо щелочным (7,2—7,4), при необходимости подщелачивать растворами соды. Если вещество нестойко, гидрофильно, то рабочую дозу необходимо периодически проверять. Повторное титрование рабочих доз необходимо и в случаях поступления новой партии вещества, находящегося на стадии лабораторного 10
синтеза, химическая чистота которого не гарантируется изготовителем.
Рабочие дозы для кожных и конъюнктивальных проб титруют на интактных животных, применяя несколько разведений. Рабочая доза для провокационной пробы (определенная концентрация раствора, взятая в рекомендуемом в описании методики объеме) не должна вызывать у таких животных видимой реакции слизистой или кожи.
Рабочие дозы для лабораторных иммунологических тестов подбирают путем постановки теста с кровью интактного животного, используя несколько разведений аллергена. Добавление аллергена в рабочей дозе к крови интактных животных не должно увеличивать спонтанного уровня лизиса, агломерации лейкоцитов и повреждения нейтрофилов.
4.2. Постановка капельной кожной пробы
Одну каплю испытуемого вещества наносят на кожу середины боковой поверхности туловища. В качестве растворителя удобнее пользоваться летучими полиэфирными веществами (ацетон, спирт), при использовании водных растворов кожу подсушивают под вентилятором. Из нерастворимых веществ готовят мазь на вазелине или ланолине, которую втирают на участок кожи размером 1X1 см.
При использовании одновременно нескольких ингредиентов сложных продуктов целесообразно для каждой пробы выстригать отдельное «окошко» размером 1X1 см, чтобы кожа вне аппликации была защищена шерстью. Кожные пробы у опытных животных и контрольных нужно ставить на одних и тех же участках боковой поверхности туловища. При повторном тестировании пробу делают на новом участке кожи.
Реакцию кожи учитывают визуально или с помощью колориметрической линейки С. В. Суворова через 24 часа и оценивают в баллах по следующей шкале:
0 — видимой реакции нет,
1 — бледно-розовая эритема по всему участку или по его пе
риферии,
2 — ярко-‘розовая эритема по всему участку или по его пери
ферии,
3 — красная эритема по всему участку,
4 — инфильтрация и отек кожи (утолщение кожной складки)
при наличии пли отсутствии эритемы,
5 — эритема, выраженная инфильтрация, очаговые изъязвле
ния (некроз), возможны геморрагии, образование корочек.
Гиперергическая реакция на 5 баллов развивается крайне редко и в ряде случаев не через 24 часа, а через 3—4 суток.
11
Следует отметить также возможность развития замедленно-немедленных реакций Джонса — Мота, проявляющихся эритемой через 6—8 часов.
Подбор концентрации раствора и мази для тестирования осуществляется путем однократной аппликации на 5—6 морских свинках, соблюдая правила постановки и учета кожной пробы. При этом при подборе концентрации для опытов по внутрикож* ной сенсибилизации используют животных, которым за 10 суток в кожу уха вводят растворитель, который будет применен при приготовлении сенсибилизирующей дозы; для опытов по эпику-танной и ингаляционной сенсибилизации — концентрацию подбирают на интактных морских свинках. Для тестирования выбирают максимальную концентрацию, не вызывающую видимой реакции кожи через 24 часа.
4.3. Постановка внутрикожной пробы
Внутрикожные пробы ставят с белковыми и полисахаридными аллергенами, с вытяжками из полимерных и сложных продуктов, а также с высоко летучими химическими соединениями (например, с фураном). В качестве растворителя, как пра-вило, применяют физиологический раствор, однако допустимо применение растительного или минерального масла. Раствор изучаемого вещества вводят в объеме 0,1 мл. Растворитель для контроля вводят в том же объеме на расстоянии 2 см, располагая на одинаковом расстоянии от середины бока животного. Следует учитывать, что кожа живота более чувствительна, однако она тоньше и внутрикожное введение в нее требует навыка.
Реакцию учитывают через 20—30 мин. (аллергическая реакция быстрого типа), 4—6 часов (замедленно-немедленного типа) и 24 часа (замедленного типа), путем измерения диаметра эритемы, инфильтрата (папулы) или отека. Рекомендуется инструментальное измерение толщины кожной складки, а также учет некроза. Оценивают реакцию в баллах с учетом реакции контрольных несенсибилизированных животных на растворитель. Так, например, отрицательной (на 0 баллов) следует считать реакцию, выражающуюся через 24 часа развитием папулы с просяное зерно при введении масляных растворов аллергенов, поскольку аналогичная воспалительная реакция возникает на одно масло у контрольных несенсибилизированных животных.
Подбор рабочей концентрации испытуемого вещества осуществляют по принципу подбора концентраций для капельных проб, используя внутрикожное ввеедние.
4.4. Постановка конъюнктивальной пробы
Одну каплю водного раствора испытуемого аллергена вводят глазной пипеткой с вытянутым тонким концом под верхнее ве-12
ко морской свинки, во второй глаз (контрольный) — одну каплю воды. Закапывание удобно проводить при положении животного головой вниз. Реакцию учитывают через 15 минут (Реакция немедленного типа) и через 24 чаас (реакция замедленного типа) и оценивают в баллах по шкале:
0 — видимой реакции нет;
1 — легкое покраснение слезного протока;
2 — покраснение слезного протока и склеры в направлении к
роговице;
3 — покраснение всей конъюнктивы и склеры (как осложнение
возможно развитие гнойного офтальмита).
Подбор концентрации раствора испытуемого аллергена осуществляется путем закапывания раствора разной концентрации в глаз интактных морских свинок. Концентрации растворов про-мышленых аллергенов для конъюнктивальной пробы обычно ниже, чем для капельных кожных тестов.
4.5. Постановка РСЛЛ
В две пробирки или две лунки планшета вносят по 0,05 мл физиологического раствора, причем во вторую (опытную), в отличие от контрольной пробы, вносят физиологический раствор, в котором растворена рабочая доза испытуемого вещества. Затем в обе пробирки добавляют по 0,1 мл исследуемой крови и инкубируют их при 37° С в течение 2 часов. После инкубации для разрушения эритроцитов кровь из контрольной и опытной пробирок в количестве по 0,02 мл переносят соответственно в две пробирки или 2 лунки планшета, содержащие по 0,4 мл 3% водного раствора уксусной кислоты. Подсчитывают абсолютное количество лейкоцитов в обеих пробах и рассчитывают показатель реакции по формуле:
Л контроль — Л опыт
показатель РСЛЛ в % =-=*---100,
Л контроль
где Л — абсолютное количество лейкоцитов.
Реакция расценивается как положительная при показателе 10% и выше.
Подбор рабочей концентрации осуществляют с кровью интактных морских свинок, выбирая такую, при добавлении которой показатели РСЛЛ не превышают 10%• Для многих промышленных аллергенов рабочие концентрации составляют 0,5—0,05%.
4.6. Постановка РСАЛ
В две пробирки или две лунки планшета вносят по 0,04 мл 5% раствора цитрата или 1,5% раствора трилона Б, причем во
13
вторую (опытную), в отличии от контрольной пробы, вносят цитрат или трилон Б, в которых предварительно растворена рабочая доза испытуемого вещества. Затем в обе пробирки добавляют по 0,2 мл крови и инкубируют их при 37° С в течение 2 часов. После инкубации готовят толстые мазки на обезжиренных предметных стеклах, которые высушивают при комнатной температуре в течение суток и без фиксации окрашивают 0,01% водным раствором метиленового синего в течение 10 минут. В каждом препарате подсчитывают по 500 лейкоцитов, отдельно учитывая число клеток, образующих агрегаты из 3 и более лейкоцитов, а затем вычисляют процент агломерированных лейкоцитов. Показатель РСАЛ оценивается по величине отношения процента агломерации в опытном мазке (АО) к проценту агломерации в контрольном мазке (АК), при этом реакция считается положительной, если процент агломерированных лейкоцитов в опытной пробе выше или ниже показателя агломерации контроля в 1,5 раза. Слабая и умеренная сенсибилизация сопровождается увеличением агломерации лейкоцитов под влиянием аллергена; при высокой интенсивности возможен лизис агломерированных клеток, вследствие чего процент РСАЛ остановится существенно ниже спонтанного уровня агломерации. Для оценки интенсивности РСАЛ в баллах используют следующую шкалу:
1 — превышение % АО по отношению к % АК в 1,5 раза;
2 — превышение % АО по отношению % АК в 2 раза;
3 — превышение % АО по отношению к % АК в 3 раза;
4 — превышение % АО по отношению к % АК в 4 раза;
5 — уменьшение % АО по отношению к % АК в 1,5 раза;
6 — уменьшение % АО,по отношению к % АК в 2 раза;
7 — уменьешение % АО по отношению к % АК в 3 раза;
8 — уменьшение % АО по отношению к % АК в 4 раза.
Подбор рабочей концентрации осуществляют с кровью интактных морских свинок и в качестве таковой выбирают раствор, добавление которого не изменяет спонтанного уровня агломерации лейкоцитов, т. е. в среднем показатель РСАЛ равен 1,0. Для большинства промышленных аллергенов рабочие разведения составляют 0,1—0,001%,
47. Постановка тестов повреждения (ППН) и альтерации (ТАН) нейтрофилов
Исследуемую кровь в количестве по 0,08 мл добавляют в две центрифужные пробирки или видалевские, содержащие: первая опытная — 0,02 мл 5% раствора цитрата натрия, в котором растворена рабочая доза аллергена, вторая контрольная — 14
0,02 мл 5% раствора цитрата натрия без аллергена. Обе пробирки инкубируют в течение двух часов при 37° С. Затем содержимое каждой пробирки (опытной и контрольной) с помощью пастеровской пипетки переносят на отдельное предметное стекло и шлифованным краем другого стекла готовят мазки средней толщины. Для определения ППН мазки окрашивают на гликоген по А. Л. Шабадашу, а для определения ТАН — любым методом, используемым при окраске мазков крови для подсчета лейкоцитарной формулы. Микроскопию препаратов проводят с иммерсией, просчитывают 100 нейтрофилов, учитывая для ППН клетки, имеющие псевдоподии, а для реакции альтерации —■ клетки с отчетливыми хроматинолизом, пикпозом, фрагментацией ядер, гиперхроматозом или кариолнзисом.
Оценка результата реакции: расчет показателя по формуле:
nnu Н опыт Н контроль
ППН или ТАН =-Yqq--->
где Н — соответствует абсолютному количеству поврежденных нейтрофилов.
Реакция расценивается как положительная при показателе 0,05 и выше. Подбор рабочей концентрации испытуемого аллергена осуществляют с кровью интактных морских свинок и выбирают такую, при добавлении которой показатели ППН и ТАН составляют от 0 до 0,04. Для большинства промышленных аллергенов этому соответствует 0,1—0,01%.
4.8. Постановка реакции специфической микропреципитации
(РСМП)
Свежевзятую плазму крови (допускается хранение при 4° С не более 2 часов) разводят равным объемом дистиллированной воды, перемешивают и после выдерживания в течение 15 минут при комнатной температуре вносят в кювету для определения исходной оптической плотности па фотоэлектроколориметре ФЭК-56м (светофильтр 4 пли 5) пли на спектрофотометре СФ 4А (длина волны 500 нм), затем оптическую плотность измеряют через 2 минуты после каждого добавления аллергена в порядке убывания степени его разведения (от 1 : 254 до 1:2). Объем реагирующей системы: 1,8 или 3,6 мл разведенной плазмы и соответственно 0,1 или 0,2 мл раствора аллергена. При работе с окрашенными или опалесцирующими растворами аллергенов необходимо одновременно дабавление аллергена в контрольную кювету с дистиллированной водой.
Для приготовления шкалы аллергена вещество разводят дистиллированной водой и в режиме реакции находят максимальную концентрацию аллергена, не вызывающую изменения опти-
15
ческой плотности плазмы интактных морских свинок (для промышленных аллергенов обычно это 10,0—0,1% растворы), далее готовят 8двукратных разведений от 1 : 2 до 1 :254, которые и используют при постановке РСМП.
Реакцию учитывают по титру аллергена: первое из 8 разведений, при добавлении которого наблюдается задержка снижения или повышение оптической плотности испытуемой плазмы принимают за титр. При статистической обработке данных РСМП используют log2 основания титра.
16
Приложение 1 К Положению о порядке внедрения достижений медицинской науки в практику здравоохранения.
ОТРЫВНОЙ ЛИСТ УЧЕТА ИСПОЛЬЗОВАННЫХ МЕТОДОВ ПРОФИЛАКТИКИ, ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Направить в обл. (гор.)отдел здравоохранения или в Головной институт по подчинению.
1. МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ПОСТАНОВКЕ ИССЛЕДОВАНИИ ПО ГИГИЕНИЧЕСКОМУ НОРМИРОВАНИЮ ПРОМЫШЛЕННЫХ АЛЛЕРГЕНОВ В ВОЗДУХЕ РАБОЧЕЙ ЗОНЫ.
(наименование методического документа)
2. Утверждено ГСЭУ М3 СССР 23.01.1980 № 2121-80
(когда и кем утвержден)
3.............................................................................................................................................................................................
(кем и когда получен)
4. Количество лечебно-профилактических учреждений, которые внедрили новые методы профилакцики, диагностики, лечения, рекомендованные данным
документом ....................................................................................................................................................................
5. Формы внедрения (семинары, подготовка и переподготовка специалистов, сообщения и др.) и результаты применения метода (количество наблюдений за год, эффективность).
6. Замечания и предложения (текст)
Подпись ................................................................................................
(должность, фам.илия лица, заполнившего лист)
Пункты 1, 2 печатаются в соответствии с издаваемым документом. Пункты 3, 4, 5 заполняются учреждением, которое применило методы.
ПОСТАНОВКА ИССЛЕДОВАНИЙ ПО ГИГИЕНИЧЕСКОМУ НОРМИРОВАНИЮ ПРОМЫШЛЕННЫХ АЛЛЕРГЕНОВ В ВОЗДУХЕ РАБОЧЕЙ ЗОНЫ
Методические рекомендации
Редактор С. А. Яловская.
Технический редактор С. А. Берзння.
Сдано в набор 16.12.80. Подписано в печать 5.01.81 ЯТ 70420. Формат 60x90/16. Бумага ти-погр. Литер. гарнитура. Высокая печать. Тираж 500 экз. 0,85 уч.-изд. л, Физ. печ. л. 1,25. Бесплатно. Заказ № 2151, Рижский медицинский институт. Рига, бульвар Падомьго, 12. Отпечатано на 4-м производстве производственного объединения «Полиграфисте» Государственного комитета Латвийской ССР по делам издательств полиграфии и книжной торговли, Рига, ул. Акае, 5/7,
* Методические рекомендации разработаны в НИИ гигиены труда и профзаболеваний АМН СССР О. Г. АЛЕКСЕЕВОЙ, Л. А. ДУЕ-ВОЙ, Рижском медицинском институте Л. И. ИЗРАЙЛЕТОМ, НИИ резиновых и латексных изделий Н. И. ШУМСКОЙ, ВНИИ железнодорожной гигиены С. В. СУВОРОВЫМ, ВНИИ антибиотиков Г. Б. ШТЕИНБЕРГ.
В настоящих методических рекомендациях впервые приведена единая схема постановки токсиколого-аллергологических экспериментов, проводимых с целью установления санитарного стандарта промышленных аллергенов в воздухе рабочей зоны.
* Методические рекомендации рассчитаны па врачей-токсикологов НИИ гигиенического профиля и ведомственных токсикологических лабораторий, занимающихся обоснованием санитарных стандартов вредных веществ в воздухе рабочей зоны.
@ Министерство здравоохранения ЛатвССР,
1980
ВВЕДЕНИЕ
Настоящие «Методические рекомендации» разработаны в дополнение к «Методическим указаниям к постановке исследований для обоснования санитарных стандартов вредных веществ в воздухе рабочей зоны».
Широкое использование в различных отраслях промышленности и сельского хозяйства полимерных, синтетических и природных соединений и сложных продуктов, обладающих свойствами аллергенов, а также расширение производств микробиологической промышленности по изготовлению различных биологически активных препаратов и продуктов привело к значительному увеличению контингента рабочих, имеющих профессиональный контакт с аллергенами. В настоящее время в структуре профессиональной заболеваемости значительное место занимают профессиональные аллергозы (экзема, аллергический дерматит, бронхиальная астма, аллергические поражения верхних дыхательных путей и глаз). В связи с этим очевидна необходимость учета сенсибилизирующего действия при установлении ПДК вредных веществ, тем более что пороги специфического действия части промышленных химических аллергенов ниже порогов токсического действия, а для многих препаратов биологического происхождения сенсибилизирующий эффект является ведущим.
Показаниями для оценки сенсибилизирующего действия вещества при установлении его ПДК в воздухе рабочей зоны являются:
1) данные литературы о сенсибилизирующем действии нормируемого вещества, в частности установление его ПДК в атмосферном воздухе пли воде водоемов по аллергенному эффекту;
2) принадлежность нормируемого вещества к классу химических соединений и сложных продуктов, среди которых ранее были выявлены аллергены (например, к ароматическим нитросоединениям, изоцианатам, фурансодсржащим соединениям, эпоксидам, альдегидам; соединениям и материалам, содержащим хром, никель, кобальт, марганец, бернлий, платину; замас-ливателям стекловолокна; полимерным материалам на основе
3
формальдегида, эпоксидов, малеинового ангидрида, капролактама; микробным препаратам, кормовым дрожжам, антибиотикам и т. д.);
3) наличие в структуре нового соединения или сложного продукта реактогенных группировок, характерных для химических аллергенов (например, амино-, эпокси-, динитрофенильных групп, гетероциклов, ионов металлов-аллергенов и т. д.);
4) появление характерных жалоб или признаков аллергических поражений у работающих в контакте с нормируемым веществом;
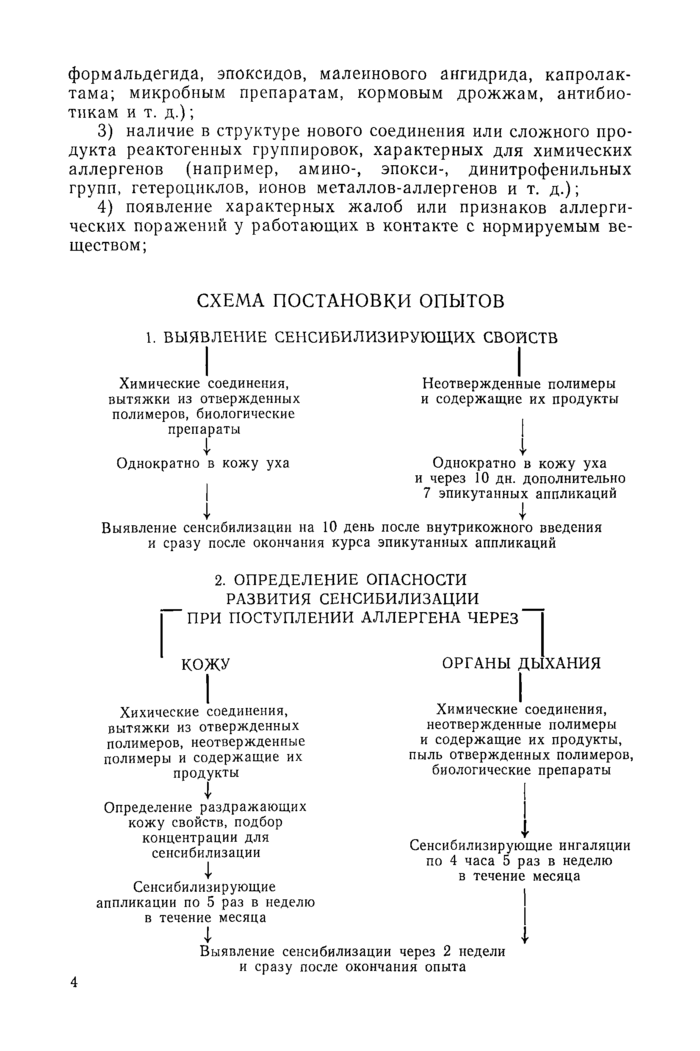
СХЕМА ПОСТАНОВКИ ОПЫТОВ
1. ВЫЯВЛЕНИЕ СЕНСИБИЛИЗИРУЮЩИХ СВОЙСТВ
Неотвержденные полимеры и содержащие их продукты
I
I
Однократно в кожу уха и через 10 дн. дополнительно 7 эпикутанных аппликаций
Химические соединения, вытяжки из отвержденных полимеров, биологические препараты
4
Однократно в кожу уха
I I
Выявление сенсибилизации на 10 день после внутрикожного введения и сразу после окончания курса эпикутанных аппликаций
2. ОПРЕДЕЛЕНИЕ ОПАСНОСТИ РАЗВИТИЯ СЕНСИБИЛИЗАЦИИ ПРИ ПОСТУПЛЕНИИ АЛЛЕРГЕНА ЧЕРЕЗ
КОЖУ ОРГАНЫ ДЫХАНИЯ
|
Определение раздражающих кожу свойств, подбор концентрации для сенсибилизации 4Сенсибилизирующие аппликации по 5 раз в неделю в течение месяца 4 |
Химические соединения, неотвержденные полимеры и содержащие их продукты, пыль отвержденных полимеров, биологические препараты I
|
5) обнаружение в процессе проведения подострых и хронических токсикологических экспериментов у животных косвенных признаков развития сенсибилизации: базо- и эозинофилин, плаз-матизации и эозинофилин тканей, лимфоидной пролиферации, гистаминемии и т. д.
Исследования проводят в два этапа (см. схему). На первом этапе используют экспрессные методы сенсибилизации с целью получения в короткий срок доказательств аллергизирующих свойств нормируемого вещества. Кроме того, первый этап позволяет ориентировочно оценить опасность аллергена по силе его специфического действия. Если в экспериментах первого этапа обнаружено сенсибилизирующее действие вещества, то проводят второй этап исследования, включающий определение опасности поступления аллергена через наиболее вероятные в условиях производства пути — через кожу и органы дыхания. При этом в опытах по эпикутанному воздействию оценивают также опас“ ность развития контактного неаллергического дерматита, а при ингаляционном введении устанавливают величину порога сенсибилизирующего действия (Lima?)> учитываемую при установлении санитарного стандарта.
Исследования проводят на морских свинках массой 250— 300 г, белой масти или хотя бы имеющих крупные белые пятна на боках туловища. Исследования можно проводить на животных обоего пола. Количество морских свинок в опытных и контрольных группах должно быть одинаковым и не менее 8—10 животных в группе.
1. ПОСТАНОВКА ОПЫТОВ ПО ВЫЯВЛЕНИЮ СЕНСИБИЛИЗИРУЮЩИХ СВОЙСТВ ИЗУЧАЕМЫХ СОЕДИНЕНИЙ, ПОЛИМЕРНЫХ И СЛОЖНЫХ ПРОДУКТОВ
Первичную оценку химических соединений, препаратов биологического происхождения и вытяжек из отвержденных полимеров проводят путем однократной внутрикожной сенсибилизации, которая исключает влияние факторов, связанных с особенностями путей поступления аллергена на производстве, и позволяет в течение 10 дней получить ответ о наличии или отсутствии сенсибилизирующих свойств. С этой целью в кожу наружной поверхности уха морской свинки туберкулиновым шприцем вводят однократно 0,02 мл раствора, содержащего 50 мкг испытуемого вещества. Контрольным животным вводят 0,02 мл растворителя (дистиллированная вода, ацетон, спирт и пр.). Для большинства промышленных аллергенов развитие сенсибилизации наступает при введении морской свинке 50—100 мкг, для очень слабых аллергенов сенсибилизирующей дозой является
5
150—200 мгк. Если и с этой дозой сенсибилизации выявить не удалось, то делается заключение о том, что изучаемое вещество не является промышленным аллергеном. При выявлении сенсибилизации после введения 200 мкг или меньших доз, приступают к исследованию второго этапа.
Первичную оценку неотвержденных полимеров и содержащих их продуктов проводят путем комплексной сенсибилизации, поскольку содержание аллергенных ингредиентов в них невелико и не обеспечивает оптимальную сенсибилизирующую дозу при внутрикожном введении в ухо. Кроме того, эти продукты, как правило, плохо всасываются, что также уменьшает действующую дозу. В связи с этим, на 10 сутки после однократного введения 200 мгк продукта в кожу уха морской свинке дополнительно проводят 7 эпикутанных аппликаций нативным продуктом или его 50% раствором.
Выявление сенсибилизации проводят через 10—12 дней после однократной сенсибилизации, а при комплексной — на следующий день после окончания эпикутанных аппликаций. Тестирование начинают с постановки кожных тестов: с биологическими препаратами, вытяжками из полимерных материалов и высоко летучими химическими соединениями ставят внутрикож-ные, а с остальными веществами — эпикутанные пробы. После их учета (через 24—48 часов после постановки) берут кровь для выполнения 1—2 лабораторных иммунологических тестов.
2. ПОСТАНОВКА ОПЫТОВ ПО ОПРЕДЕЛЕНИЮ ОПАСНОСТИ РАЗВИТИЯ СЕСИБИЛИЗАЦИИ ПРИ ПОСТУПЛЕНИИ АЛЛЕРГЕНА ЧЕРЕЗ КОЖУ И ОРГАНЫ ДЫХАНИЯ
При оценке опасности накожного пути поступления аллергена опыты проводят с химическими соединениями, вытяжками из отвержденных полимеров, неотвержденными полимерами и содержащими их продуктами.
Первоначально определяют раздражающие кожу свойства испытуемого вещества на 5—6 морских свинках. Для этого на освобожденную от шерсти кожу боковой поверхности, ближе к середине туловища, наносят по 3 капли испытуемого вещества в чистом виде и в разведениях 1:2, 1:10, 1:100 по 5 раз в неделю в течение 2-х недель. В случае образования нерастворимой пленки последнюю удаляют через 4 часа водой или нетокстичным растворителем (спирт, ацетон); в остальных случаях кожу дополнительно не обрабатывают. Реакцию кожи учитывают ежедневно по шкале оценки капельных кожных проб. Этот эксперимент позволяет выявить опасность развития неаллергического контактного дерматита и одновременно подо-6
брать оптимальную концентрацию вещества для последующей сенсибилизации, т. е. максимальную концентрацию, не вызывающую при многократных аппликациях выраженного контактного неаллергического дерматита от раздражающего действия.
Затем проводят исследование сенсибилизирующего действия вещества путем 20 повторных (по 5 раз в неделю) накожных аппликаций на участок боковой поверхности туловища размером 2X2 см. Если наносят жидкость, то ее дозируют пипеткой и берут 3 капли. Если применяют мазь, то ее наносят равномерным тонким слоем на весь участок аппликации с помощью глазной стеклянной лопаточки. Более 20 накожных аппликаций проводить не следует, так как они могут оказать гипосенсибилизирующее действие.
Выявление сенсибилизации теми же методами, что и на первом этапе, проводят после 10 аппликаций и, в случае ее обнаружения, дальнейшее нанесение вещества можно прекратить. При отрицательном или сомнительном результате число аппликаций обязательно доводят до 20, после которых опытных животных тестируют повторно.
В опытах по ингаляционному воздействию используют химические соединения, неотвержденные полимеры и содержащие их продукты, биологические препараты и пыль отвержденных полимеров. Эксперименты проводят на морских свинках путем четырехчасовых ингаляционных воздействий по 5 раз в неделю в течение месяца. Учитывая возможность подавления аллергических реакций при развитии интоксикации, эксперимент начинают с концентрации, соответствующей Lim,./?, и с концентрацией на порядок ниже. В большинстве случаев этот прием позволяет определить величину пороговой концентрации по сенсибилизирующему эффекту (Lima/), за которую принимают концентрацию, вызывающую развитие сенсибилизации у отдельных животных (у 1—2 морских свинок из 8—10). Следует иметь в виду, что среднегрупповые показатели при пороговой концентрации могут достоверно не отличаться от таковых группы параллельного контроля. Недействующая по сенсибилизирующему эффекту концентрация ниже пороговой обычно в 3—5 раз.
Для выявления сенсибилизации при ингаляционном воздействии применяют конъюнктивальную пробу, как более чувствительную при этом пути поступления аллергена по сравнению с кожными, и 2—3 лабораторных иммунологических тестов.
3. ОЦЕНКА ОПАСНОСТИ ХИМИЧЕСКОГО АЛЛЕРГЕНА И РЕКОМЕНДАЦИИ К УСТАНОВЛЕНИЮ ПДК
Итогом исследования должны явиться материалы для прогнозирования опасности развития профессиональных аллергиче-
7
скнх заболеваний при контакте работающих с изучаемым веществом и установление санитарного стандарта с учетом ал-лергизирующего эффекта.
Опасность промышленных аллергенов оценивают по результатам всех проведенных токсиколого-аллергологических опытов. Наибольшую опасность представляют аллергены, сенсибилизирующий эффект которых выявлен при всех способах введения в организм, а величина Limaz не менее чем в 3—5 раз меньше величины 1лтс/г. К умеренно опасным промышленным аллергенам относятся химические соединения, полимерные и сложные продукты, которые, хотя и вызывают сенсибилизацию при всех способах введения, но величина Lima; которых достоверно не отличается от величины Limc/i. При отрицательных результатах эпикутанной и ингаляционной, но положительной внутрикожной сенсибилизации, промышленный аллерген следует рассматривать как практически неопасный.
Активность аллергена в пределах каждого класса опасности определяет мииимальная сенсибилизирующая доза или конценг рация, например, величина Lima;. При одинаковых величинах минимальных сенсибилизирующих доз или концентраций более активным аллергеном следует считать тот, который вызывает сенсибилизацию у большего числа животных в более ранние сроки, более интенсивные и продолжительные аллергические реакции.
При установлении ПДК промышленных аллергенов в воздухе рабочей зоны необходимо придерживаться следующих положений:
1. Если Limaz не менее чем на порядок ниже Limc/f, то ПДК должна устанавливаться на уровне недействующей по сенсибилизирующему эффекту концентрации с отметкой «аллерген».
Коэффициент запаса к недействующей концентрации не вводится, так как сама методика определения ее величины предусматривает снижение концентрации по сравнению с Limai в 3— 5 раз.
2. Если результатами опытов по ингаляционному воздействию установлено, что Limaz выше или равен Limc/b то ПДК следует устанавливать по токсическому действию с отметкой «аллерген».
3. Если изучаемое соединение, полимер или сложный продукт, относится к классу практически неопасных промышленных аллергенов, то ПДК устанавливается с учетом L\mCh без пометки «аллерген».
4.. МЕТОДЫ ВЫЯВЛЕНИЯ СЕНСИБИЛИЗАЦИИ
Из приемов аллергодиагностики in vivo технически наиболее простыми являются кожные тесты и конъюнктивальная проба Показания к их применению изложены в разделах 1 и 2.
8
Из лабораторных иммунологических методов оценки сенсибилизации как технически наиболее простые рекомендуются на выбор: для выявления реакции клеток крови на аллерген in vitro — реакции специфического лизиса лейкоцитов (РСЛЛ), специфической агломерации лейкоцитов (РСАЛ), тесты определения показателя повреждения (ППН) или альтерации (ТАН) нейтрофилов, а для определения гуморальных антител — реакция специфической микропреципитации (РСМП).
Данный набор методик не ограничивает инициативы исследователей, поскольку в настоящее время имеется много методов аллергодиагностики, которые могут быть использованы для выявления сенсибилизации к промышленным аллергенам у морсикх свинок: воспроизведение анафалитического шока при внутривенном или внутрисердечном введении аллергена, реакция усиления пиронинофилии лейкоцитов, реакция торможения миграции макрофагов, определение специфических бляшко- и розеткообразующих лимфоцитов, реакция специфической бласт-трансформации лимфоцитов, реакция пассивной гемагглютина-ции, непрямые тесты дегрануляции базофилов и тучных клеток, пассивная кожная анафилаксия по Овари.
Использование полимерных и содержащих их продуктов возможно только при постановке кожных и конъюнктивальных проб. В иммунологических реакциях, как правило, применяют растворы входящих в их состав химических соединений. Использование ингредиентов полимерных продуктов при тестировании, в том числе при кожных и конъюнктивальных пробах, позволяет понять их роль в сенсибилизирующем действии полной композиции и подойти к решению гигиенической регламентации их состава.
Сенсибилизирующий эффект промышленных аллергенов оценивают не только по интенсивности сенсибилизации, т. е. по средней арифметической каждого специфического показателя, но обязательно и по числу сенсибилизированных животных, учитывая одновременно результаты всех примененных методик.
Для выявления сенсибилизации морских свинок к промышленным аллергенам дополнительно могут также использоваться и некоторые неспецифические показатели, такие как увеличение абсолютного или относительного количества эозинофилов и базофилов, концентрации в сыворотке крови биогенных аминов (гистамин, серотонин и др.), плазматизация и эозинофилия тканей. Особое значение неспецифические показатели приобретают при изучении продуктов нерасшифрованного состава, когда невозможна постановка лабораторных иммунологических реакций.
При оценке среднегрупповых показателей методов аллергодиагностики (кожные, конъюнктивальные пробы, лабораторные иммунологические реакции) используют определение критерия
9