ГОСТ Р 54354-2011
Мясо и мясные продукты. Общие требования и методы микробиологического анализа
Купить ГОСТ Р 54354-2011 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Распространяется на мясо (все виды убойных животных), полуфабрикаты, субпродукты, колбасные изделия и продукты из мяса и устанавливает общие требования и методы микробиологического анализа. Выявление и определение микроорганизмов: - количества мезофильных аэробных и факультативно-анаэробных микроорганизмов (КМАФАнМ); - бактерий группы кишечных палочек (колиформных бактерий - БГКП); - бактерий рода Proteus; - бактерий рода Pseudomonas; - дрожжей и плесневых грибов; - молочнокислых микроорганизмов; - сульфитредуцирующих клостридий; - энтерококков; - бактерий рода Salmonella; - Listeria monocytogenes; - Escherichia coli; - Staphylococcus aureus; - коагулазоположительных стафилококков; - Yersinia enterocolitica; - бактерий рода Campylobacter; - Bacillus cereus.
Рекомендуется использовать вместо ГОСТ 4288-76 (в части пункта 2.11; ИУС 11-2012)
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Средства измерений, аппаратура, лабораторная посуда, материалы и реактивы
5 Питательные среды
6 Общие требования к проведению микробиологического анализа
7 Подготовка к проведению анализа
8 Проведение анализа
9 Требования безопасности
10 Приложение А (справочное) Перечень рекомендуемых микробиологических питательных сред .
Библиография
| Дата введения | 01.01.2013 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
Организации:
| 12.07.2011 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 180-ст |
|---|---|---|---|
| Разработан | ГНУ ВНИИМП им. В.М. Горбатова Россельхозакадемии | ||
| Издан | Стандартинформ | 2013 г. |
Meat and meat products. Organization and methods of microbiological testing
- ГОСТ 23932-90 Посуда и оборудование лабораторные стеклянные. Общие технические условия
- ГОСТ 4233-77 Реактивы. Натрий хлористый. Технические условия
- ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 10444.11-89Продукты пищевые. Методы определения молочнокислых микроорганизмов. Заменен на ГОСТ 10444.11-2013.ГОСТ 10444.12-88Продукты пищевые. Метод определения дрожжей и плесневых грибов. Заменен на ГОСТ 10444.12-2013.- ГОСТ 10444.15-94 Продукты пищевые. Методы определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов
- ГОСТ 10444.1-84 Консервы. Приготовление растворов реактивов, красок, индикаторов и питательных сред, применяемых в микробиологическом анализе
ГОСТ 10444.8-88Продукты пищевые. Метод определения Bacillus cereus. Заменен на ГОСТ 10444.8-2013.- ГОСТ 10929-76 Реактивы. Водорода пероксид. Технические условия
- ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
- ГОСТ 13646-68 Термометры стеклянные ртутные для точных измерений. Технические условия
- ГОСТ 13739-78 Масло иммерсионное для микроскопии. Технические требования. Методы испытаний
- ГОСТ 14919-83 Электроплиты, электроплитки и жарочные электрошкафы бытовые. Общие технические условия
- ГОСТ 16317-87 Приборы холодильные электрические бытовые. Общие технические условия
- ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
- ГОСТ 21239-93 Инструменты хирургические. Ножницы. Общие требования и методы испытаний
- ГОСТ 21240-89 Скальпели и ножи медицинские. Общие технические требования и методы испытаний
- ГОСТ 21241-89 Пинцеты медицинские. Общие технические требования и методы испытаний
- ГОСТ 21400-75 Стекло химико-лабораторное. Технические требования. Методы испытаний
- ГОСТ 24363-80 Реактивы. Калия гидроокись. Технические условия
- ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
- ГОСТ 2603-79 Реактивы. Ацетон. Технические условия
- ГОСТ 26669-85 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов
- ГОСТ 28560-90 Продукты пищевые. Метод выявления бактерий родов Рrоtеus, Morganella, Providencia
- ГОСТ 28566-90 Продукты пищевые. Метод выявления и определения количества энтерококков
ГОСТ 29185-91Продукты пищевые. Методы выявления и определения количества сульфитредуцирующих клостридий. Заменен на ГОСТ 29185-2014.- ГОСТ 29227-91 Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
- ГОСТ 3118-77 Реактивы. Кислота соляная. Технические условия
- ГОСТ 3145-84 Часы механические с сигнальным устройством. Общие технические условия
- ГОСТ 3640-94 Цинк. Технические условия
- ГОСТ 4148-78 Реактивы. Железо (II) серно-кислое 7-водное. Технические условия
- ГОСТ 4172-76 Реактивы. Натрий фосфорно-кислый двузамещенный 12-водный. Технические условия
- ГОСТ 4328-77 Реактивы. Натрия гидроокись. Технические условия
- ГОСТ 5556-81 Вата медицинская гигроскопическая. Технические условия
- ГОСТ 6006-78 Реактивы. Бутанол -1. Технические условия
- ГОСТ 6038-79 Реактивы. D-глюкоза. Технические условия
- ГОСТ 6672-75 Стекла покровные для микропрепаратов. Технические условия
- ГОСТ 9284-75 Стекла предметные для микропрепаратов. Технические условия
- ГОСТ 9412-93 Марля медицинская. Общие технические условия
- ГОСТ 9792-73 Колбасные изделия и продукты из свинины, баранины, говядины и мяса других видов убойных животных и птиц. Правила приемки и методы отбора проб
- ГОСТ Р 50454-92 Мясо и мясные продукты. Обнаружение и учет предполагаемых колиформных бактерий и Еsсhеriсhiа соli (арбитражный метод)
- ГОСТ Р 50455-92 Мясо и мясные продукты. Обнаружение сальмонелл (арбитражный метод)
- ГОСТ Р 51447-99 Мясо и мясные продукты. Методы отбора проб
- ГОСТ Р 51448-99 Мясо и мясные продукты. Методы подготовки проб для микробиологических исследований
- ГОСТ 30726-2001 Продукты пищевые. Методы выявления и определения количества бактерий вида Escherichia coli
- ГОСТ Р 51921-2002 Продукты пищевые. Методы выявления и определения бактерий Listeria monocytogenes
ГОСТ 24788-2001Посуда хозяйственная стальная эмалированная. Общие технические условия. Заменен на ГОСТ 24788-2018.- ГОСТ Р 51935-2002 Стерилизаторы паровые большие. Общие технические требования и методы испытаний
- ГОСТ Р 51652-2000 Спирт этиловый ректификованный из пищевого сырья. Технические условия
- ГОСТ Р 52830-2007 Микробиология пищевых продуктов и кормов. Метод обнаружения и определения количества презумптивных бактерий Escherichia coli. Метод наиболее вероятного числа
- ГОСТ Р 52814-2007 Продукты пищевые. Метод выявления бактерий рода Salmonella
- ГОСТ Р 52816-2007 Продукты пищевые. Методы выявления и определения количества бактерий группы кишечных палочек (колиформных бактерий)
- ГОСТ Р 52815-2007 Продукты пищевые. Методы выявления и определения количества коагулазоположительных стафилококков и Staphylococcus aureus
- ГОСТ Р ИСО 11133-1-2008 Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 1. Общие руководящие указания по обеспечению качества приготовления культуральных сред в лаборатории
- ГОСТ Р ИСО 11133-2-2008 Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 2. Практические руководящие указания по эксплуатационным испытаниям культуральных сред
- ГОСТ Р ИСО 7218-2008 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям
- ГОСТ Р 54004-2010 Продукты пищевые. Методы отбора проб для микробиологических испытаний
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24

стр. 25
стр. 26
стр. 27

стр. 28

стр. 29
стр. 30
ГОСТ Р 54354 — 2011
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
НАЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
МЯСО И МЯСНЫЕ ПРОДУКТЫОбщие требования и методы микробиологического анализа
Издание официальное
Москва
Стандартинформ
2013
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании», а правила применения национальных стандартов Российской Федерации — ГОСТ Р 1.0-2004 «Стандартизация в Российской Федерации. Основные положения»
Сведения о стандарте
1 РАЗРАБОТАН Государственным научным учреждением Всероссийским научно-исследовательским институтом мясной промышленности им. В.М. Горбатова Российской академии сельскохозяйственных наук (ГНУ ВНИИМП им. В.М. Горбатова Россельхозакадемии)
2 ВНЕСЕН Техническим комитетом по стандартизации ТК226 «Мясо и мясная продукция»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 12 июля 2011 г. № 180-ст
4 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе «Национальные стандарты», а текст изменений и поправок— в ежемесячно издаваемых информационных указателях «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования— на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
©Стандартинформ,2013
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
Набор реактивов для окраски по Граму.
Натрия гидроокись, ч. д. а., по ГОСТ 4328.
Натрий гиппурат 99 %.
Натрий метабисульфит.
Натрий лаурил сульфат.
Натрий пировинограднокислый, ч.
Натрий хлористый по ГОСТ 4233.
Нингидрин 99 %.
Оксидазные диски.
Пероксид водорода по ГОСТ 10929.
Полимиксин В сульфат.
Полимиксин М сульфат.
Раствор перекиси водорода 3 %.
Реагент Ковача.
Спирт амиловый, не содержащий органических щелочей.
Спирт бутиловый, не содержащий органических щелочей (основной).
Спирт бутиловый нормальный, ч. д. а., по ГОСТ6006.
Спирт этиловый ректификованный по ГОСТ Р 51652.
Индикатор феноловый красный.
Ферментативный перевар молока и животных протеинов.
Ферментативный перевар казеина.
Ферментативный гидролизат сои.
Натрий фосфорнокислый двузамещенный Na2HP04 (безводный), ч. д. а., по ГОСТ4172.
Натрий фосфорнокислый однозамещенный NaHP04H20.
Хлористый магний 6-водный (МдС12 6Н20).
Цинк-порошок по ГОСТ 3640.
4.2 Аппаратура для ускоренных методов анализа
Для ускоренных методов анализа используют следующую аппаратуру:
- при выявлении колиформныхбактерий, сальмонелл, энтерококков, дрожжей и плесневых грибов, Clostridium perfringens, листерий методом измерения электрического сопротивления (импеданса) с использованием приборов «Рэбит» — по [3], Бак Трак — по [4];
- при выявлении и определении бактерий рода Salmonella и Listeria monocytogenes на основе гетерогенной твердофазной дезоксирибонуклеиновой кислоты — рибонуклеиновой кислоты (ДНК-РНК) гибридизации с хемилюминесцентным детектированием (прибор «Люмипроб») — по [5] со следующими дополнениями: пробирочный люминометр «Люмлайт» или планшетный люминометр—фотомер «PhL», инкубатор-встря-хиватель, 96-луночные и 192-луночные микропланшеты с ДНК-зондом, автоматическая пипетка на 0,04 см3 и наконечники, многоканальные пипетки 0,04 — 0,3 см3, кюветы для реагентов, адсорбирующие салфетки;
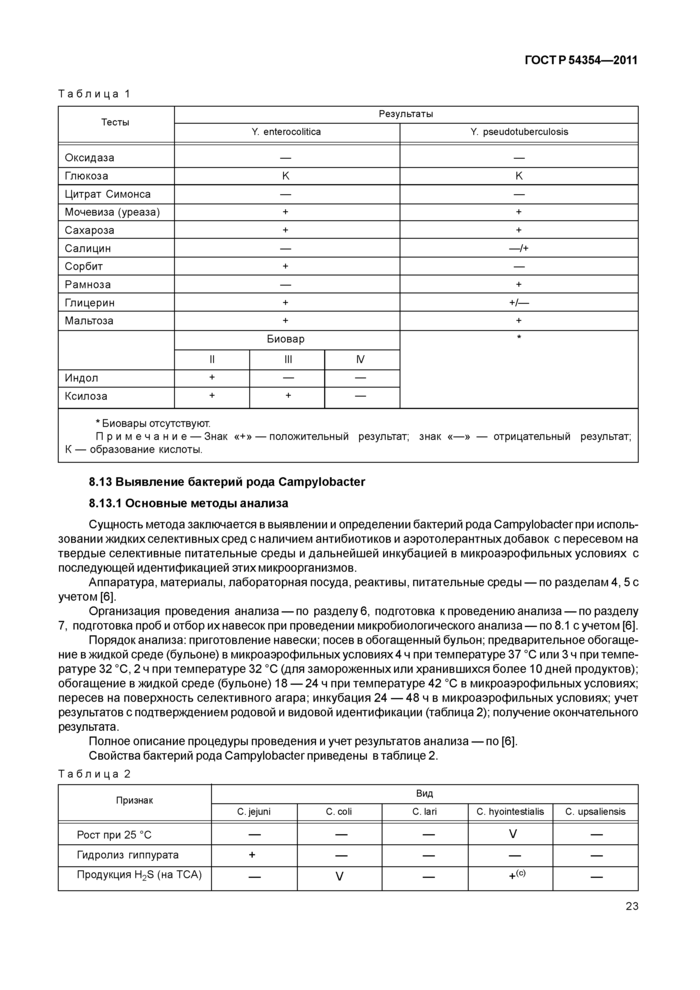
- при выявлении бактерии рода Campylobacter— по [6];
- при выявлении возбудителя иерсиниоза — по [7];
- при использовании анализатора Vidas/ mini Vidas для выявления бактерий рода Salmonella — по [8];
- при идентификации микроорганизмов родов Salmonella, Campylobacter на основе ПЦР с использованием системы Бакс (Вах system Q7) — по [9];
- при выделении и идентификации Е. coli 0157:Н7 — по [10];
- при проведении санитарно-микробиологического контроля мясных продуктов на наличие Listeria monocytogenes с использованием анализатора Vidas/mini Vidas — по [8], ГОСТ Р 51921;
- при идентификации микроорганизмов с использованием стриповых наборов канализатору Vidas/ mini Vidas или другим устройствам (приборам) в соответствии с прилагаемой инструкцией по их применению; иммунохроматографические экспресс-тесты для выявления бактерий рода Salmonella, бактерий Listeria monocytogenes, Е. coli 0157:Н7, бактерий рода Campylobacter и других микроорганизмов, разрешенные к применению в пищевой промышленности.
Допускается применение других средств измерений с метрологическими характеристиками, аппаратуры с техническими характеристиками, реактивов по качеству не ниже указанных в настоящем стандарте.
8
ГОСТ P 54354—20115 Питательные среды
Рекомендуемые питательные среды для выполнения основных микробиологических анализов, разрешенные к применению в пищевой промышленности, приведены в приложении А.
Рекомендуемые питательные среды для использования при ускоренных методах анализа приведены в [3] — [16].
Допускается применение других питательных сред по качеству не ниже указанных в настоящем стандарте и зарегистрированных (разрешенных) к применению при контроле продукции в пищевой промышленности.
6 Общие требования к проведению микробиологического анализа
6.1 Общие требования проведения микробиологического анализа — по ГОСТ Р ИСО 7218.
6.1.1 Основные методы анализа применяют при получении окончательных результатов, в том числе идентификации микроорганизмов — по ГОСТ Р ИСО 7218.
При производственном контроле вместо питательных сред, содержащихся в чашках Петри многократного или одноразового применения, разрешается использовать подложки (пластины). Для биохимической идентификации выделенной микрофлоры допускается использование тест-систем промышленного производства, разрешенных к применению в пищевой промышленности по [3] — [16].
6.1.2 Ускоренные методы предназначены для осуществления производственного контроля, идентификации культур микроорганизмов, выделенных с использованием основных методов контроля и (или) скрининговых испытаний — по [3] — [16]. При получении положительных результатов этими методами проводят подтверждающие анализы с использованием основных микробиологических и других методов (биохимических, серологических ит. д.). Окончательным результатом считают данные, полученные с использованием основных методов.
6.2 Подготовка помещений, аппаратуры, средств измерений, питательных сред, растворов, лабораторной посуды к проведению анализа — по ГОСТ Р ИСО 7218.
6.3 Требования к персоналу — по ГОСТ Р ИСО 7218.
6.4 Обеспечение качества проведения анализа6.4.1 Контроль режимов паровой и суховоздушной стерилизации
6.4.1.1 Химический и термический контроли режима стерилизации — по ГОСТ Р ИСО 7218.
6.4.1.2 Биологический контроль осуществляют два раза в год, используя биотесты, предназначенные для контроля паровой или суховоздушной стерилизации конкретного вида и разрешенные к применению в пищевой промышленности.
6.4.2 Контроль санитарно-микробиологических показателей воздушной среды помещений лаборатории — по ГОСТ Р ИСО 7218 с учетом 6.4.2.1,6.4.2.2.
6.4.2.1 Микробиологический контроль воздуха в боксах или в ламинарных шкафах проводят не реже одного раза в неделю перед началом выполнения анализа. Отбор пробы воздуха в количестве 100 дм3 проводят согласно инструкции к используемому прибору.
Инкубируют посевы при (37 ± 1) °С в течение (24 ± 2) ч.
6.4.2.2 Допустимый уровень общего содержания микроорганизмов не более 500 КОЕ/м3 [17] при использовании аспирационного метода.
6.4.3 Контроль санитарно-микробиологических показателей поверхностей объектов производственной лаборатории — по ГОСТ Р ИСО 7218 с учетом 6.4.3.1,6.4.3.2.
6.4.3.1 Контроль проводят с целью проверки эффективности санитарной обработки поверхности объектов путем обнаружения колиформныхбактерий.
6.4.3.2 Анализ выполняют не реже одного раза в месяц перед началом работы методом смыва или прямого контакта питательной среды с исследуемой поверхностью. Контролируют микробиологические боксы, помещения для проведения микробиологических анализов.
Отбор проб выполняют со стен бокса, с поверхности рабочих столов на каждом рабочем месте, с дверных ручек, наружных деталей приборов.
При контроле мелких предметов смывы берут с поверхности всего предмета. При контроле предметов с большой поверхностью смывы проводят с площади не менее 100 см2.
9
6.4.4 Оценка эффективности ультрафиолетового бактерицидного излучения — по [18] сучетом 6.4.4.1.
6.4.4.1 Бактерицидную эффективность ультрафиолетового облучения помещения БЭ, %, вычисляют по формуле
БЭ = ((Л/д — Л/п)/Л/д)-100,
где Л/д —число микроорганизмов до облучения;
Л/п —число микроорганизмов после облучения.
Ультрафиолетовое бактерицидное облучение помещений считается эффективным, если бактерицидная эффективность составляет не менее 99 %.
6.4.5 Контроль качества дистиллированной воды — по ГОСТ 6709.
6.4.6 Требования к обеззараживанию и подготовке лабораторного оборудования, материалов, инструментов и лабораторной посуды — по ГОСТ Р ИСО 7218.
6.4.7 Хранение и использование эталонных культур микроорганизмов — по ГОСТ Р ИСО 7218.
6.4.8 Контроль питательных сред — по ГОСТ Р ИСО 11133-1, ГОСТ Р ИСО 11133-2, ГОСТ 10444.1 (пункт 4), с учетом 6.4.8.1 —6.4.8.3.
6.4.8.1 Контроль условий и сроков хранения питательных сред
Сухие питательные среды и реактивы, если не указаны особые условия хранения, хранят при температуре 10 °С — 25 °С; готовые к применению питательные среды (плотные, полужидкие, жидкие), доставленные с предприятия-изготовителя, хранят при температуре 2 °С — 8 °С в соответствии со сроками, указанными на этикетке.
Вскрытые упаковки со средами хранят плотно закрытыми.
Готовые питательные среды хранят при температуре 2 °С — 8 °С. Сроки хранения готовых питательных сред определяет изготовитель.
Все питательные среды маркируют с указанием названия среды, даты приготовления и срока годности.
6.4.8.2 Контроль питательных сред на этапе приготовления
Контроль питательных сред на этапе приготовления включает в себя следующее: оценку внешнего вида готовой среды, измерение pH готовой среды, определение стерильности (отсутствие контаминации) готовой среды, постановку качественного контроля биологических свойств среды.
Расплавленные питательные среды хранят не более 8 ч. Повторное плавление и использование плотной питательной среды не допускается.
Чашки Петри с внесенной стерильной питательной средой хранят не более одной недели при условии сохранения их состава.
7 Подготовка к проведению анализа
7.1 Отбор, транспортирование, приемка и хранение проб
7.1.1 Отбор проб — по ГОСТ 9792, ГОСТ Р 51447, ГОСТ 26668, ГОСТ 26669, [19] а также в соответствии с нормативными документами на продукты конкретных видов с учетом ниже приведенного.
Пробы отрезают стерильным ножом или другими стерильными инструментами.
Из отобранных по ГОСТ 9792 (пункт 1.3) единиц продукции отбирают объединенную пробу:
- от туши, полутуши, четвертины, мясокостных отрубов, бескостных (обваленных) отрубов, жилованного мяса и от крупнокусковых бескостных полуфабрикатов — целый кусок бескостного мяса размером 8 х 10 х 10 см и массой не менее 500 г;
- от крупнокусковых и мелкокусковых мясокостных полуфабрикатов, порционных бескостных полуфабрикатов отбирают пробу, в которой бескостная часть составляет не менее 500 г;
- от мясного блока, в зависимости от способа обработки мяса, отбирают целый кусок бескостного мяса массой не менее 500 г или мясо, в котором бескостная часть составляет не менее 500 г;
- от тримминга, мяса механической обвалки (дообвалки), пищевых суб продукте в, в том числе замороженных, кишок-сырца, кишок-полуфабрикатов, кишок-фабрикатов, от мелкокусковых и порционных бескостных, порционных мясокостных, рубленых мясных (мясосодержащих), формованных кусковых (рубленых), фаршированных полуфабрикатов, мясного (мясосодержащего) фарша и от полуфабрикатов панированных, в тесте, мясного (мясосодержащего) кулинарного изделия отбирают продукт общей массой не менее 500 г;
ГОСТ P 54354—2011
- от колбасных изделий отбирают не менее двухточечных проб на расстоянии 15 см от края батона и из них составляют объединенную пробу. Если длина колбасного изделия не более 15 см, то отбирают два батона целиком;
- сосиски и сардельки (точечные пробы) отбирают из разных мест партии, не нарушая целостности единиц продукции, при этом из несколькихточечных проб составляют объединенную пробу;
- от партии языков из двух единиц продукции, с выполнением мер стерильности по всей толщине продукта, вырезают пробы длиной не менее 8 см каждая и из них составляют объединенную пробу;
- от продуктов из говядины, свинины, баранины и мяса других видов животных отрезают точечные пробы по всей толщине продукта длиной не менее 10 см от двух единиц продукции и из двухточечных проб составляют объединенную пробу;
- от окорока, изготовленного из тазобедренной части туши, срез делают шириной не менее 10 см и отбирают по всей толщине продукта в месте сочленения берцовой и бедренной костей;
- от окорока, изготовленного из лопаточной части туши, срез шириной 10 см делают и отбирают по всей толщине продукта в месте сочленения лопатки и плечевой кости;
- от изделий без оболочки (студни, паштеты и др.) точечные пробы отбирают не менее чем от трех единиц изделий массой 200 — 250 г каждая.
7.1.2 Транспортирование, приемка и хранение проб — по ГОСТ Р ИСО 7218, ГОСТ Р 54004.
8 Проведение анализа8.1 Подготовка проб и отбор их навесок при микробиологическом анализе
Подготовка проб и отбор их навесок для микробиологического анализа включает в себя размораживание (при необходимости), стерильное вскрытие упаковки (при исследовании упакованных мясных продуктов), обжиг поверхности пробы или отбор навески без стерилизации ее поверхности и измельчение проб — согласно ГОСТ Р 51448, ГОСТ 26669.
Без стерилизации (обжига) поверхности продукта осуществляют отбор проб от следующих продуктов: тримминга, мяса механической обвалки (дообвалки), пищевых субпродуктов (кроме печени, почек, сердца), кишок-сырца, кишок-полуфабрикатов и кишок-фабрикатов, мелкокусковых бескостных (мясокостных) полуфабрикатов, порционных бескостных (мясокостных) полуфабрикатов, рубленых мясных (мясосодержащих) полуфабрикатов, мясного (мясосодержащего) фарша, формованных кусковых (рубленых) полуфабрикатов, фаршированных полуфабрикатов, полуфабрикатов в тесте, панированных полуфабрикатов, мясных (мясосодержащих) кулинарных изделий, колбасных изделий и продуктов из мяса в нарезке (высота до 5 см), упакованных под вакуумом или в модифицированную газовую среду.
Масса навески зависит от установленныхтребований на исследуемый микробиологический показатель.
В зависимости от вида исследуемой продукции объединенную пробу массой 70 — 80 г составляют из точечных проб следующим образом: колбасные изделия в оболочке и продукты из свинины, баранины и говядины помещают в металлический или эмалированный лоток, тщательно протирают ватным тампоном, смоченным спиртом, и дважды обжигают пламенем (спирт этиловый ректификованный по ГОСТ Р 51652 или другими средствами, разрешенными для этих целей).
Затем батоны колбасных изделий разрезают продольно стерильным (фламбированным) ножом или скальпелем на две половинки, не рассекая оболочку противоположной стороны батона.
Из свиных, бараньих, говяжьих продуктов на костях и бекона пробы вырезают стерильным инструментом из различных участков обожженного образца на глубине 2 — Зсм от поверхности, предпочтительно ближе к кости.
Изделия без оболочки (мясные хлебы, паштеты, студни и др. изделия) исследуют с поверхности и из глубины продукта.
Для анализа поверхности изделий без оболочки, после развертывания упаковки, с поверхности исследуемых образцов делают смыв (с каждого образца новым стерильным увлажненным ватным тампоном) с тех участков, с которыми могли соприкасаться руки упаковщика, и исследуют согласно ГОСТ Р 52816 на наличие БГКП.
Для анализа глубинных участков этого вида продукта образцы помещают в металлический или эмалированный лоток, смачивают спиртом и обжигают. Затем делают продольный разрез и отбирают навеску методом, указанным для колбасных изделий и продуктов в оболочке, составляя из них одну объединенную пробу, которую помещают в предварительно взвешенную стерильную бюксу или чашку Петри.
Из объединенной пробы каждого образца берут в стерильную посуду (пакет для гомогенизации) 20 г продукта с погрешностью, не превышающей 0,1 г.
Навеску помещают в стерильную емкость (колбу, стакан, пакет) гомогенизатора для приготовления испытуемой взвеси. Для этого к навеске добавляют в четырехкратном количестве 0,1 %-ную пептонную воду или стерильный физиологический раствор и гомогенизируют.
Для посевов на питательные среды стерильной градуированной пипеткой отбирают надосадочную жидкость после 15 мин выдержки при комнатной температуре, учитывая, что в 1 см3 исходной суспензии содержится 0,2 г продукта.
8.2 Определение количества мезофильных аэробных и факультативно-анаэробных микроорганизмов (КМАФАнМ)
Подготовка исследований, проведение и учет результатов анализа — по ГОСТ 10444.15 с учетом разделов 4 — 7, 8.1 и ниже приведенного.
Ряд десятикратных разведений зависит от предполагаемой контаминации продукта.
Для подсчета количества выросших колоний микроорганизмов, кроме учета в ручном режиме, допускается использовать также приборы: счетчики микроорганизмов для ручного контроля, автоматические анализаторы различных типов, разрешенные к применению в пищевой промышленности.
При применении пластин (подложек) питательных сред [12], [13], [15] или других типов, разрешенных к применению в пищевой промышленности, подготовку к анализу, приготовление разведенной пробы выполняют по 8.1.
Пластины питательной среды, предназначенные для подсчета КМАФАнМ, представляют собой готовую систему для нанесения исследуемого образца, содержащую набор питательных веществ, растворимых в холодной воде; в систему может также быть включен тетразолиевый индикатор, облегчающий учет микроорганизмов.
Оптимальный рост микроорганизмов обеспечивается при анализе образца продукта и его разведений в интервале pH 3,7 — 7,5.
Подготовка проб к анализу — по 8.1.
Пластины (подложки) помещают на ровную поверхность питательной среды. Из подготовленного образца или его соответствующих разведений отбирают 1,0 см3 взвеси, снимают крышку пластинчатого устройства (чашки) и в центр пластины вносят отобранный объем взвеси. Внесенная взвесь диффундирует и равномерно распределяется по поверхности матерчатой подложки, трансформируя ее в гель в течение нескольких секунд. При выполнении контроля санитарного состояния поверхностей оборудования, рук персонала, упаковки и других объектов прикладывают к ним предварительно увлажненные пластины (подложки). После чего покровную пленку (крышку) пластины (подложи) закрывают и ставят ее в термостат, располагая в горизонтальном положении крышкой вниз. Допускается размещать чашки друг на друга по 20 шт. Затем посевы инкубируют 24 — 48 ч при температуре 30 °С — 35 °С.
Учет результатов анализа — по ГОСТ 10444.15.
При этом учитывают все колонии красного цвета независимо от их размера и интенсивности окраски, что облегчает получение результатов анализа.
8.3 Выявление и определение бактерий рода Salmonella8.3.1 Основные методы анализа
Подготовка к анализу, проведение и обработка результатов анализа — по ГОСТ Р 50455, ГОСТ Р 52814 с учетом разделов 4 — 7 и ниже приведенного.
Хромогенные и флюорогенные питательные среды являются питательными средами нового поколения, принцип действия которых основан на выявлении высокоспецифичных ферментов у искомых микроорганизмов. В состав этих сред входит хромогенный субстрат — вещество, при расщеплении которого ферментами, специфичными для определенного вида микроорганизмов, образуются окрашенные и/или флюоресцирующие продукты. В результате колонии искомых микроорганизмов окрашиваются в определенный цвет или приобретают способность к флюоресценции при ультрафиолетовом облучении.
В плотной хромогенной среде [11] присутствие дезоксисилата натрия ингибирует сопутствующую грамположительную микрофлору.
Посев материала на эту среду осуществляют из жидкой селективной среды. Инкубируют посевы в аэробных условиях 24 — 48 ч при температуре 35 °С — 37 °С. Обработка результатов анализа — по ГОСТ Р 50455, ГОСТ Р 52814.
ГОСТ P 54354—2011
Сальмонеллы при культивировании на этой хромогенной среде образуют кислоту из пропиленгликоля и под воздействием изменения индикатора pH их колонии окрашиваются в красный цвет. Хромогенный субстрат, также имеющийся в составе среды, гидролизуется ферментом р-галактозидазой, продуцируемым колиформами, в результате чего колонии колиформных бактерий при росте на этой среде приобретают сине-зеленый или сине-фиолетовый цвет, а остальные энтеробактерии остаются бесцветны.
Плотные селективные хромогенные среды других типов (приложение А) для выделения и идентификации сальмонелл имеют питательную основу из нескольких видов пептонов и содержат три хромогенных субстрата, что обеспечивает рост всех штаммов Salmonella и позволяет определять их специфическую ферментативную активность. Дифференциация штаммов Salmonella, в том числе сбраживающих лактозу, от других бактерий основана на том, что продуценты эстеразы образуют розовые или розовато-лиловые колонии. Прочие бактерии образуют колонии других цветов. Селективная смесь ингибирует рост большинства грамположительных бактерий и дрожжей.
Посев материала на эту питательную среду осуществляют из жидкой селективной среды. Инкубируют посевы в аэробных условиях 18 — 24 ч при температуре 35 °С — 37 °С.
Полужидкие агаризованные среды предназначены для выявления подвижных штаммов сальмонелл, диффузный рост которых в толще этих сред проявляется от центра к периферии (ГОСТ Р 52814).
В состав питательной среды пластин (подложек) для анализа сальмонелл входят питательные вещества с добавлением хромогенного субстрата и антибиотика, например, новобиоцина. Посев пробы выполняют из среды накопления: открывают поверхностную защитную пленку пластины (подложки), затем в центр среды вносят 1 см3 материала и термостатируют при температуре 43 °С до 48 ч. При этом сальмонеллы формируют зеленые или черные колонии за счет распада хромогенного субстрата, присутствующего в среде. Среда вокруг колоний сальмонелл меняет цвет с фиолетового на желтый. При высокой концентрации колоний сальмонелл вся поверхность среды может быть желтого цвета. При выявлении на этой среде подозрительных на сальмонеллы колоний их идентифицируют по ГОСТ Р 52814.
Пластифицированные среды пластин (подложек) другихтипов (приложение А) могут содержать питательные вещества с добавлением хромогенного субстрата и дезоксихолата натрия, ингибирующего рост грамположительной микрофлоры. Посев пробы выполняют, как указано выше, термостатируют 24 ч при температуре 35 °С. Сальмонеллы ферментируют ксилозу и декарбоксилируют лизин до кадаверина, что сопровождается повышением pH и выделением сероводорода, который, соединяясь сжелезом, образует сульфит железа, придающий колониям черный цвет.
В состав пластифицированной среды подложек (пластин) для комплексного выявления сальмонелл/Enterobacteriacae входит модифицированный агар, а также субстраты X-a-Gal (ферментируемый а-галактозидазой) и Salmon-p-Gal (ферментируемый р-галактозидазой). Посев и термостатирование пробы выполняют, как указано выше. При инкубации сальмонеллы формируют голубые или зелено-голубые колонии, вто время как другие энтеробактерии формируют колонии пурпурного цвета.
Результаты анализа оценивают по каждой пробе отдельно.
Интерпретацию результатов анализа выявленных культур проводят по ГОСТ Р ИСО 7218.
Если культуры предположительно отнесены к бактериям рода Salmonella, то окончательную идентификацию проводят по ГОСТ Р ИСО 7218. В этом случае результаты выявления бактерий рода Salmonella выдают после получения ответа по окончательной идентификации.
Результаты анализа записывают следующим образом: «бактерии рода Salmonella обнаружены или не обнаружены в 25 см3 жидкого или 25 г сухого продукта».
8.3.2 Ускоренные методы анализа
8.3.2.1 Подготовка и выполнение анализа — в соответствии с разделами 4, 6, 7, [3] — [5], [8],
[11], [20].
а) Метод выявления и определения бактерий рода Salmonella на основе гетерогенного твердофазного гибридизационного ДНК-РНК анализа с хемилюминесцентной детекцией — по [5].
Этот метод является основой функционирования микробиологического анализатора на базе пробирочного люминометра. Его применяют для ускоренного выявления сальмонелл непосредственно из продуктов питания и/или подтверждения выделенных микробиологическими методами культур этих бактерий. Общее время выявления бактерий рода Salmonella составляет 24—48 ч.
Сущность метода: основан и действует на принципе гибридизации участка бактериального генома с закрепленным на твердофазном носителе (стенке пробирки) комплементарным к определяемой последовательности ДНК сальмонелл олигонукпеотидным зондом, меченным флюоресцентным красителем, с последующей детекцией гибридов по степени иххемилюминесценции.
13
Порядок выполнения метода: из точечных проб мясной продукции отбирают 25 г и вносят в обогатительный бульон (225 см3), если масса пробы иная, чем 25 г, используют необходимое количество неселективной среды, исходя из соотношения 1:10; гомогенизируют пробу, выполняют посев и термостатируют его при температуре (37 ± 1) °С в течение 16 — 18 ч; переносят 1 см3 из обогатительного бульона в 100 см3 селективного бульона и инкубируют посев 18 — 24 ч при температуре (41,5 ± 0,5) °С для накопления сальмонелл; затем проводят обработку культуральной жидкости лизирующим буфером для денатурации бактериальной оболочки сальмонелл и высвобождения рибосомной РНК; выполняют гибридизацию фрагментов рибосомной РНК с комплементарным меченым зондом; осуществляют хемилюменесцентое детектирование продуктов реакции.
Порядок ускоренной идентификации бактерий рода Salmonella: отбор трех—пяти характерных колоний сдифференциально-диагностическихсред; пересев их на питательный агар и инкубирование при температуре 37 °С в течение 24 ч; обработка суточной культуры лизирующим буфером для денатурации бактериальной клетки и высвобождения рибосомальной РНК; гибридизация фрагментов рибосомной РНК с комплементарным меченым ДНК-зондом; хемилюминесцентное детектирование продуктов реакции. Общее время детекции бактерий рода Salmonella этим методом составляет 2 ч.
Описание проведения и учета результатов анализа — по [5].
При выявлении бактерий рода Salmonella результаты подтверждают в соответствии с ГОСТ Р 52814.
б) Метод, основанный на использовании принципа импеданса
Подготовка и выполнение этого метода — по разделам 4,6,7, 8.1, [3], [4].
Сущность метода основана на принципе измерения сопротивления (импеданса) в жидкой питательной среде, специфической для исследуемого микроорганизма, в зависимости от содержания в ней контролируемых микробных клеток.
Проведение и учет результатов анализа — по [3], [4].
в) Метод полимеразно-цепной реакции (ПЦР) для идентификации сальмонелл [9]
Сущность метода основана на обнаружении специфических целевых нуклеотидных последовательностей ДНК, присутствующих в микроорганизмах, посредством полимеразной цепной реакции в реальном
времени.
Используют этот метод, особенно при затруднениях в идентификации сальмонелл взамен расширенного набора биохимическихтестов, в случаях отсутствия агглютинации культуры с поливалентной О-сыво-роткой (А, В, С, D, Е) и со смесью О-сывороток редких групп при положительном результате стандартного набора биохимическихтестов; при предположительном результате в случае наличия агглютинации с сыворотками редких групп сальмонелл; нетипичных результатах биохимическихтестов (отклонения по двум и более признакам).
Порядок проведения анализа:
- подготовка аппаратуры, материалов, реактивов и питательных сред в соответствии с установленными требованиями;
- выявление и накопление биомассы бактериальных культур для идентификации, для чего отбирают отдельные колонии с агаризованных селективно-диагностических питательных сред;
- подготовка образцов чистых культур к анализу на анализаторе (смывы с поверхности питательной среды с концентрацией клеток в 1 см3 не менее 5-106);
- проведение лизиса и выделение ДНК;
- подготовка к проведению ПЦР;
- ампфликация и детекция;
- создание протокола (файла) анализа.
Полное описание проведения и учета результатов анализа — по [9].
г) Метод иммуноферментного анализа
Сущность метода: выявление сальмонелл основано на применении комплекса высокоспецифичных антител к антигенам О и Н, что позволяет определить как подвижные, так и неподвижные штаммы сальмонелл после предварительного неселективного обогащения проб.
Порядок проведения анализа: подготовка проб — по 8.1; предварительное неселективное обогащение сальмонелл — по 8.3.1; процедура иммуноконцентрации с использованием анализатора для автоматизированного определения сальмонелл; интерпретация результатов; биохимическое подтверждение принадлежности выделенных характерных микроорганизмов к бактериям рода Salmonella; оценка результатов анализа.
Проведение и учет результатов анализа — по [8].
ГОСТ P 54354—2011
При положительном результате анализа его подтверждают по ГОСТ Р 52814.
д) Твердофазный иммуноферментный анализ с использованием полистирольных планшет
Сущность метода основана на выявлении сальмонелл путем постановки иммуноферментной реакции
[20].
Анализ выполняют с использованием полисти рольных планшетов, покрытых моноклональными антителами к термостабильному антигену сальмонелл. Использование твердой фазы позволяет надежно разделять компоненты реакции за счет специфичной иммунной сорбции сальмонелл и коньюгатов на поверхности планшета.
Результатом проведения ИФА является образование легко детектируемого комплекса антиген-антитело (сэндвича) в лунках с положительными исследуемыми пробами и положительным контролем. При наличии сальмонелл раствор в лунках окрашивается в синий цвет. Для фиксации результатов реакции в лунки добавляют останавливающий реагент, что сопровождается изменением синего цвета на желтый.
Процедура проведения анализа: предобогащение 25 г пробы в 225 см3 забуференной пептонной воды в течение 18 — 24 ч при температуре 37 °С; обогащение в течение 18 — 24 ч при температуре (45,0 ± 0,5) °С 1 см3 жидкой фазы из среды предобогащения в 10 см3 бульона Раппопорта-Вассилиадиса; перенос по 1 см3 культуральной жидкости после селективного обогащения в отдельную пробирку, каждая из которых содержит 10 см3 модифицированного GN-бульона (сдобавкой 10 мкг/см3 новобиоцина); инкубирование 4 — 6 ч при температуре (45,0 ± 0,5) °С; автоклавирование смеси бульонов (по 1 см3) при температуре 120 °С или на кипящей водяной бане 20 мин; охлаждение бульона для последующего исследования методом ИФА; подготовка рабочих разведений растворов, входящих в комплект тест-системы; извлечение из пакетов необходимого количества стрипов; внесение по 0,1 см3 исследуемых бульонов положительного и отрицательного контролей в соответствующие лунки; инкубирование планшета при комнатной температуре в течение 30 мин; промывание лунок; добавление по 0,1 см3 конъюгата моноклональных антител с пероксидазой; инкубация планшета при комнатной температуре в течение 30 мин; промывание лунок; добавление субстрата и выдержка планшета при комнатной температуре в темноте 30 мин; визуальный учет, остановка реакции и интерпретация результатов.
Подтверждение положительных результатов — по ГОСТ Р 50455, ГОСТ Р 52814.
При использовании тестовой системы для выявления сальмонелл процедура проведения анализа состоит из следующих этапов: предобогащение 25 г пробы в 225 см3 забуференной пептонной воды 16 — 20 ч при температуре (35 ± 1) °С — (37 ± 1) °С; иммунохимическое связывание на планшете в течение 30 мин при температуре (35 ± 1) °С — (37 ± 1) °С; отмывка планшета, реактивация поврежденных клеток сальмонелл в лунках планшета в течение 4 ч при температуре (35 ± 1) °С — (37 ± 1) °С; добавление в лунки по 0,1 см3 коньюгата; инкубация в течение 30 мин при температуре (35 ± 1) °С — (37 ± 1) °С; вторая отмывка планшета; добавление в лунки 0,1 см3 субстрата/хромогена; инкубация в течение 15 мин при комнатной температуре в темноте; добавление стоп-раствора.
С помощью 96-луночного ИФА-планшета можно выполнять анализы от одного до 94 образцов одновременно как при визуальной, так и автоматической оценке результатов.
При положительных результатах анализа на наличие сальмонелл проводят биохимическое и серологическое тестирование и окончательно оценивают результаты анализа по ГОСТ Р 50455.
е) Биохимическая идентификация микроорганизмов рода Salmonella с применением тест-систем (стрипов) промышленного производства, зарегистрированных в Российской Федерации
Для биохимической идентификации признаков бактерий рода Salmonella допускается использовать наборы тест-систем, зарегистрированных в Российской Федерации.
Порядок использования тест-систем и учет результатов анализа — по ГОСТ Р 52814 (пункт 8.5).
ж) Метод выявления патогенных микроорганизмов с использованием экспресс-тестов — по [11 ].
Иммунохроматографические экспресс-тесты предназначены для выявления патогенных микроорганизмов и представляют собой диагностическую тест-панель с лункой для внесения образца, окном стесто-вой и контрольной зонами. Экспресс-тест содержит иммобилизованные на подложке меченные золотом антитела, обладающие высокой специфичностью к определяемым микроорганизмам.
Сущность действия экспресс-тестов основана на методе визуальной иммунохроматографии — разновидности иммуноферментного анализа. Антигены определяемых бактерий, присутствующие в исследуемом образце, взаимодействуют с меченными золотом антителами с образованием комплекса антиген-антитело. При прохождении по подложке теста комплекс антиген-антитело связывается с иммобилизованными антителами, образуя красные линии в тестовой и контрольной зонах, свидетельствующих о наличии искомого микроорганизма в исследуемом образце.
Процедура проведения анализа состоит из следующих этапов.
15
Неселективное обогащение: навеску анализируемого образца массой (25,0 ± 0,1) г или объемом (25,0 ± 0,1) см3 вносят в 225 см3забуференной пептонной воды. При необходимости анализа других масс (объемов) образца их посев проводят в забуференную пептонную воду в соотношении 1 : 9 по объему. Твердые образцы измельчают в гомогенизаторе. Посевы инкубируют при температуре (37 ± 1) °С в течение (21 ±3)ч.
Селективное обогащение: 0,1 см3 обогащенной культуры после неселективного обогащения переносят в 9,9 см3 среды Раппопорт-Василиадиса. Посевы инкубируют при температуре (41 ± 1) °С в течение (21 ±3)ч.
Инактивация сальмонелл: 1—2 см3 культуры, полученной после селективного обогащения, переносят в пробирку. Инактивируют обогащенную культуру на водяной бане при температуре 80 °С в течение 20 мин. Оставшуюся после селективного обогащения культуру используют для подтверждения положительных результатов.
Тестирование сальмонелл: инактивированную культуру охлаждают до комнатной температуры. Переносят 0,16 см3 инактивированной культуры в лунку для внесения образца теста.
Учет результатов анализа: учитывают результаты через 20 мин после внесения инактивированной исследуемой культуры в тестовую лунку. При этом выявляют наличие линий в тестовой (Т) и контрольной (С) зонах. Результат теста считается положительным, если красная линия присутствует как в тестовой (Т), так и в контрольной (С) зоне. Результат теста считают отрицательным, если красная линия присутствует только в контрольной (С) зоне. Результат теста считается недействительным, если красная линия отсутствует как в тестовой (Т), так и в контрольной (С) зоне.
Положительный результат подтверждают по ГОСТ Р 52814.
8.4 Выявление и определение Listeria monocytogenes
8.4.1 Основные методы анализа
8.4.1.1 Подготовка, проведение и обработка результатов исследований — по ГОСТ Р 51921 со следующим дополнением.
Хромогенные и флюорогенные питательные среды — по 8.3.1.
В хромогенной среде Оттавиани-Агости (приложение А) наличие ингибиторов подавляет рост некоторых видов листерий (L. seeligeri, L. grayi, L. welshimeri), грамположительных и грамотрицательных бактерий, а также дрожжей и плесневых грибов. Рост L. monocytogenes и L. innocua не подавляется, а рост L. ivanovii — задерживается. Все листерии обладают активностью фермента p-D-глюкозидазы и образуют при взаимодействии схромогенным субстратом сине-зеленые колонии. L. monocytogenes выявляется по наличию фермента фосфатидилинозит-фосфолипазы С. Фосфолипазная активность выявляется по наличию зоны просветления вокруг колоний L. monocytogenes. Кроме L. monocytogenes только L. ivanovii проявляет фосфолипазную активность.
Посев на поверхность хромогенной среды выполняют микробиологической петлей со сред обогащения, приведенных в разделе 5.
Инкубируют посевы 24 ч при температуре 37 °С. При отрицательном результате продлевают инкубацию еще на 24 ч. Все сине-зеленые колонии с зоной просветления среды вокруг колоний учитывают предположительно как наличие Listeria monocytogenes. Для получения окончательных результатов подозрительные колонии изучают по ГОСТ Р 51921.
В хромогенной питательной среде «Основа диагностического агара для листерий» (приложение А) дифференциация L. monocytogenes от других видов листерий основана на выявлении активности фосфати-дилинозит-специфичной фосфолипазной С активности и ферментации а-метил-О-маннозида. Фермент фосфолипаза С является важным специфическим ферментом и встречается только у L. monocytogenes и L. ivanovii. Он гидролизует очищенный субстрат (FD227), добавляемый в среду, в результате чего вокруг колоний листерий формируется зона помутнения среды. Дифференциация колоний L. monocytogenes и L. ivanovii при этом основана на утилизации а-метил-О-маннозида. L. monocytogenes ферментирует этот субстрат, формируя желтый ореол вокруг колоний, который отсутствует вокруг колоний L. ivanovii.
При получении положительных результатов на наличие L. monocytogenes с использованием хромогенных и флюорогенных питательных сред результаты подтверждают анализом колоний этих микроорганизмов по ГОСТ Р 51921, в том числе системы биохимической идентификации.
ГОСТ P 54354—2011
8.4.2 Ускоренные методы анализа
8.4.2.1 При подготовке к анализам и их выполнении руководствуются разделами 4,6, 7, [4], [5], [9].
а) Метод выявления и определения L. monocytogenes на основе гетерогенного твердофазного гибри-дизационного ДНК-РНК анализа с хемилюминесцентным детектированием
Его применяют для ускоренного выявления и/или подтверждения принадлежности к L. monocytogenes культур бактерий, выделенных микробиологическими методами [5].
Процедура выполнения метода: из точечных проб мясной продукции отбирают навеску 25 г, вносят в 225 см3 среды первичного накопления, и инкубируют посевы при температуре 37 °С в течение (24 ± 2) ч; затем из этого посева отбирают 0,1 см3 суспензии и вносят в 10 см3 бульона Фразера для вторичного обогащения; термостатируют посев при температуре (37 ± 1) °С в течение 48 ч; обрабатывают культуральную жидкость лизирующим буфером для денатурации бактериальной клетки и высвобождения рибосомной РНК; осуществляют гибридизацию фрагментов рибосомной РНК с комплементарным меченым ДНК-зон-дом и хемилюминесцентное детектирование продуктов реакции.
Ускоренная идентификация культур, выделенных из мясных продуктов, и определение их принадлежности к L. monocytogenes предусматривает следующее: получение суточной культуры микроорганизма; обработку суспензии суточной культуры клеток лизирующим буфером для денатурации бактериальной клетки и высвобождения рибосомной РНК; гибридизацию фрагментов рибосомной РНК с комплементарным меченым ДНК-зондом; хемилюминисцентное детектирование продуктов реакции. Общее время идентификации L. monocytogenes — 2 ч.
Описание проведения и учета результатов анализа — по [5].
б) Метод измерения электрического сопротивления (импеданса)
Подготовка к проведению анализа — по 4.2, разделам 6, 7.
Сущность метода — по 8.3.2.
Полное описание процедуры проведения и учета результатов анализа с использованием экспресс-анализатора — по [4].
в) Метод ПЦР при идентификации Listeria monocytogenes с использованием тест-систем, разрешенных к применению в пищевой промышленности, допускается использовать одновременно с определением лецитиназной и р-гемолитической активности [9].
Сущность метода — по 8.3.2.
Порядок проведения анализа — по 8.3.2. Первичный посев для выявления Listeria monocytogenes осуществляют по ГОСТ Р 51921.
Для определения принадлежности характерных колоний к Listeria monocytogenes отбирают отдельные (3—4) колонии с селективно-диагностических сред после их инкубирования и пересевают штрихами на поверхность плотных питательных сред или в пробирки сжидкими средами (триптонсоевый бульон сдрож-жевым экстрактом) и инкубируют 24 ч при температуре (37 ± 1) °С.
Полное описание процедуры проведения и учета результатов анализа — по [9].
г) Метод иммуноферментного анализа с использованием анализатора.
Сущность метода — по 8.3.2.
Проведение и учет результатов анализа — по ГОСТ Р 51921 (разделы 7,8).
д) Метод твердофазного иммуноферментного анализа
Сущность метода основана на выявлении бактерий рода Listeria, в том числе L. monocytogenes, путем постановки иммуноферментной реакции с помощью тест-систем [21]. Анализ выполняют на полисти-рольных планшетах, покрытых моноклональными антителами к антигену этих бактерий. Результатом проведения ИФА является образование легко детектируемого комплекса антиген-антитело (сэндвича) в лунках с положительными исследуемыми пробами и положительным контролем. В отсутствие листерий, а также в лунке с отрицательным контролем, иммунокомплекс не образуется. При наличии листерий раствор в лунках окрашивается в синий цвет; для фиксации результатов реакции в лунки добавляется фиксирующий реагент, при этом цвет раствора меняется на желтый.
Процедура проведения анализа: предобогащение 25 г пробы в 225 см3 бульона Фразера в течение 24 ч при температуре 30 °С; обогащение 0,1 см3 предобогащенного бульона Фразера путем его внесения в 10 см3 бульона Фразера и культивирования 24 ч при температуре 30 °С; инактивирование жизнеспособных бактерий путем тепловой обработки при температуре 100 °С в течение 20 мин после их инкубации в среде обогащения; подготовка рабочих разведений растворов, входящих в комплект тест-системы; извлечение из пакетов необходимого количества стрипов; внесение по 0,1 см3 исследуемых растворов, положительного и отрицательного контролей в соответствующие лунки; инкубирование планшета при температуре 37 °С
17
ГОСТ P 54354—2011Содержание
1 Область применения........................................ 1
2 Нормативные ссылки....................................... 1
3 Термины и определения...................................... 3
4 Средства измерений, аппаратура, лабораторная посуда, материалы и реактивы.......... 5
5 Питательные среды........................................ 9
6 Общие требования к проведению микробиологического анализа.................. 9
7 Подготовка к проведению анализа................................. 10
8 Проведение анализа........................................ 11
9 Требования безопасности..................................... 26
10 Приложение А (справочное) Перечень рекомендуемых микробиологических питательных сред . . 27
Библиография............................................ 36
30 мин; промывание лунок; добавление в лунки по 0,1 см3 коньюгата моноклональных антител с пероксида-зой; инкубация планшета при температуре 37 °С в течение 30 мин; промывание лунок, добавление субстрата и выдержка планшета при комнатной температуре в темноте 30 мин; визуальный учет, остановка реакции. Учет результатов и подтверждение положительных результатов — по ГОСТ Р 51921.
е) Иммунохроматографический экспресс-тест [11]
Сущность и принцип метода основаны на выявлении Listeria monocytogenes с использованием им-мунохроматографического теста, представляющего собой диагностическую тест-панель с лунками для внесения образца и окном с тестовой и контрольной зонами — по 8.3.2.
Процедура проведения анализа.
Предварительное селективное обогащение: навеску анализируемого образца массой (25,0 ± 0,1) г или объемом (25,0 ± 0,1) см3 вносят в 225 см3 бульона Фразера половинной концентрации или в селективный бульон для листерий (ЮВМ). При необходимости анализа других масс (объемов) образца их посев проводят в селективную среду бульон ЮВМ в соотношении 1 :9 по объему. Твердые образцы измельчают в гомогенизаторе. Посевы инкубируют при температуре (30 ± 1) °С в течение (21 ±3)ч.
Селективное обогащение: 0,1 см3 культуры после предварительного селективного обогащения переносят в 9,9 см3 бульона Фразера или бульона для обогащения листерий (ЮВМ). Посевы инкубируют при температуре (37 ± 1) °С в течение (21 ± 3) ч.
Инактивация листерий: 1 —2 см3 культуры, полученной после селективного обогащения, переносят в пробирку. Инактивируют обогащенную культуру на водяной бане при температуре 80 °С в течение 20 мин.
Оставшуюся после селективного обогащения культуру используют для подтверждения положительных результатов.
Тестирование L. monocytogenes: инактивированную культуру охлаждают до комнатной температуры. Переносят 0,18 см3 инактивированной культуры в лунку для внесения образца экспресс-теста.
Результаты анализов учитывают через 20 мин после внесения инактивированной исследуемой культуры в тестовую лунку, для чего выявляют наличие линий в тестовой (Т) и контрольной (С) зонах экспресс-теста. Результат теста считается положительным, если красная линия присутствует как в тестовой (Т), так и в контрольной (С) зоне. Результат тестирования считается отрицательным, если красная линия присутствует только в контрольной (С) зоне. Результат тестирования считают недействительным, если красная линия отсутствует как в тестовой (Т), так и в контрольной (С) зоне.
Положительный результат подтверждают, используя дифференциально-диагностические среды по ГОСТ Р 51921.
8.5 Выявление и определение энтерококков (E.faecalis, E.faecium)
8.5.1 Основные методы анализа
8.5.1.1 Подготовка, проведение и учет результатов анализа — по ГОСТ 28566 (пункты 4,5) с учетом разделов 4 — 7 и ниже приведенного.
Ряд десятикратных разведений выполняют в зависимости от предполагаемой контаминации продукта.
Хромогенная среда типа «основа хромогенного агара» для выделения и дифференциации Е. faecalis и Е. faecium, кроме питательных веществ, содержит арабинозу и хромогенный субстрат, который окрашивает колонии этих микроорганизмов в различный цвет. Е. faecalis не ферментирует арабинозу и формирует колонии синего цвета. Е. faecium ферментирует арабинозу и образует колонии зеленой окраски.
На хромогенных агаровых средах, в составе которых имеется эскулин и предназначенных для выявления энтерококков и Д-стрептококков, эти микроорганизмы гидролизуют эскулин с почернением среды. Селективность среды обеспечивается наличием в ней канамицина и азида натрия (ингибирование грамот-рицательной микрофлоры), и желчных кислот (ингибирование грамположительных микроорганизмов).
Энтерококки и стрептококки группы Д образуют характерные бесцветные или серые колонии, окруженные черным ореолом. Окончательная идентификация этих микроорганизмов с изучением их биохимических свойств — по ГОСТ 28566.
Для контроля качества среды используют штамм согласно ГОСТ Р ИСО 11133-2. На данной среде может наблюдаться рост листерий и стафилококков.
8.5.2 Ускоренный метод анализа путем измерения электрического сопротивления (импеданса)
8.5.2.1 Подготовка к анализу и сущность метода — по 8.3.2.
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИМЯСО И МЯСНЫЕ ПРОДУКТЫ Общие требования и методы микробиологического анализа
Meat and meat products. General requirements and methods of microbiological testing
Дата введения — 2013—01—01
1 Область применения
Настоящий стандарт распространяется на мясо (все виды убойныхживотных), полуфабрикаты, субпродукты, колбасные изделия и продукты из мяса и устанавливает общие требования и методы микробиологического анализа.
Выявление и определение микроорганизмов:
- количества мезофильных аэробных и факультативно-анаэробных микроорганизмов (КМАФАнМ);
- бактерий группы кишечных палочек (колиформных бактерий — БГКП);
- бактерий рода Proteus;
- бактерий рода Pseudomonas;
-дрожжей и плесневых грибов;
- молочнокислых микроорганизмов;
- сульфитредуцирующих клостридий;
- энтерококков;
- бактерий рода Salmonella;
- Listeria monocytogenes;
- Escherichia coli;
- Staphylococcus aureus;
- коагулазоположительных стафилококков;
- Yersinia enterocolitica;
- бактерий рода Campylobacter;
- Bacillus cereus.
При определении количества микроорганизмов посевом на (в) агаризованные среды результаты выражают— КОЕ (колониеобразующая единица) в 1 г продукта, при определении количества микроорганизмов по методу НВЧ (наиболее вероятное число) — количеством клеток в 1 г продукта.
При выявлении микроорганизмов в определенной массе продукта результаты выражают: «обнаружены в х г продукта» или «не обнаружены в х г продукта», где х — масса продукта г.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ Р ИСО 7218-2008 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям
ГОСТ Р ИСО 11133-1-2008 Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 1. Общие руководящие указания по обеспечению качества приготовления культуральных сред в лаборатории
Издание официальное
ГОСТР ИС011133-2—2008 Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 2. Практические руководящие указания по эксплуатационным испытаниям культуральных сред
ГОСТ Р 50454-92 (ИСО 3811—79) Мясо и мясные продукты. Обнаружение и учет предполагаемых колиформныхбактерий и Escherichia coli (арбитражный метод)
ГОСТ Р 50455-92 (ИСО 3565—75) Мясо и мясные продукты. Обнаружение сальмонелл (арбитражный метод)
ГОСТ Р 51447-99 (ИСО 3100-1—91) Мясо и мясные продукты. Методы отбора проб ГОСТ Р 51448-99 (ИСО 3100-2—88) Мясо и мясные продукты. Методы подготовки проб для микробиологических исследований
ГОСТ Р 51652-2000 Спирт этиловый ректификованный из пищевого сырья. Технические условия ГОСТ Р 51921-2002 Продукты пищевые. Методы выявления и определения бактерий Listeria monocytogenes
ГОСТ Р 51935-2002 Стерилизаторы паровые большие. Общие технические требования и методы испытаний
ГОСТ Р 52814-2007 (ИСО 6579—2002) Продукты пищевые. Методы выявления бактерий рода Salmonella
ГОСТ Р 52815-2007 Продукты пищевые. Методы выявления и определения количества коагулазопо-ложительныхстафилококков и Staphylococcus aureus
ГОСТ Р 52816-2007 Продукты пищевые. Методы выявления и определения количества бактерий группы кишечных палочек (колиформных бактерий)
ГОСТ Р 52830-2007 (ИСО 7251—2005) Микробиология пищевых продуктов и кормов. Метод обнаружения и определения количества презумптивных бактерий Escherichia coli. Метод наиболее вероятного числа
ГОСТР 54004-2010 Продукты пищевые. Методы отбора проб для микробиологических испытаний ГОСТ 1770-74 (ИС0 1042-83, ИСО 4788—80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 2603-79 Реактивы. Ацетон. Технические условия ГОСТ 3118-77 Реактивы. Кислота соляная. Технические условия
ГОСТ 3145-84 Часы механические с сигнальным устройством. Общие технические условия ГОСТ 3640-94 Цинк. Технические условия
ГОСТ 4148-78 Реактивы. Железо (II) сернокислое 7-водное. Технические условия
ГОСТ 4172-76 Реактивы. Натрий фосфорнокислый двузамещенный 12-водный. Технические условия
ГОСТ 4233-77 Реактивы. Натрий хлористый. Технические условия
ГОСТ 4328-77 Реактивы. Натрия гидроокись. Технические условия
ГОСТ 5556-81 Вата медицинская гигроскопическая. Технические условия
ГОСТ 6006-78 Реактивы. Бутанол-1. Технические условия
ГОСТ 6038-79 Реактивы. D-глюкоза. Технические условия
ГОСТ 6672-75 Стекла покровные для микропрепаратов. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 9284-75 Стекла предметные для микропрепаратов. Технические условия
ГОСТ 9412-93 Марля медицинская. Общие технические условия
ГОСТ 9792-73 Колбасные изделия и продукты из свинины, баранины, говядины и мяса других видов убойных животных и птиц. Правила приемки и методы отбора проб
ГОСТ 10444.1-84 Консервы. Приготовление растворов реактивов, красок, индикаторов и питательных сред, применяемых в микробиологическом анализе
ГОСТ 10444.8-88 Продукты пищевые. Методы определения Bacillus cereus ГОСТ 10444.11-89 Продукты пищевые. Методы определения молочнокислых микроорганизмов ГОСТ 10444.12-88 Продукты пищевые. Методы определения дрожжей и плесневых грибов ГОСТ 10444.15-94 Продукты пищевые. Методы определения количества мезофильных аэробных и факультативно-анаэробныхмикроорганизмов
ГОСТ 10929-76 Реактивы. Водорода пероксид. Технические условия
ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
ГОСТ 13646-68 Термометры стеклянные ртутные для точных измерений. Технические условия
ГОСТ 13739-78 Масло иммерсионное для микроскопии. Технические требования. Методы испытаний
2
ГОСТ P 54354—2011
ГОСТ 14919-83 Электроплиты, электроплитки и жарочные электрошкафы бытовые. Общие технические условия
ГОСТ 16317-87 Приборы холодильные электрические бытовые. Общие технические условия ГОСТ 21239-93 Инструменты хирургические. Ножницы. Общие требования и методы испытаний ГОСТ 21240-89 Скальпели и ножи медицинские. Общие технические требования и методы испытаний
ГОСТ 21241-89 Пинцеты медицинские. Общие технические требования и методы испытаний ГОСТ 21400-75 Стекло химико-лабораторное. Технические требования. Методы испытаний ГОСТ 23932-90 Посуда и оборудование лабораторные стеклянные. Общие технические условия ГОСТ 24363-80 Реактивы. Калия гидроокись. Технические условия
ГОСТ 24788-2001 Посуда хозяйственная стальная эмалированная. Общие технические условия ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 26669-85 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов ГОСТ28560—90 Продукты пищевые. Методы выявления бактерий родов Proteus, Morganella, Providencia ГОСТ 28566-90 Продукты пищевые. Метод выявления и определения количества энтерококков ГОСТ 29185-91 Продукты пищевые. Методы выявления и определения количества сульфитредуци-рующих клостридий
ГОСТ 29227-91 (ИС0 4794—94) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
ГОСТ 30726-2001 Продукты пищевые. Методы выявления и определения количества бактерий вида Escherichia coli
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяют в части, не затрагивающей эту ссылку.
3 Термины и определения
3.1 бактерии группы кишечных палочек (колиформные бактерии): Грамотрицательные, окси-дазоотрицательные, неспорообразующие палочки, сбраживающие лактозу с образованием кислоты и газа при температуре (37 ± 1) °С, принадлежащие в основном к родам — эшерихия (Escherichia), клебсиелла (Klebsiella), энтеробактер (Enterobacter), цитробакгер (Citrobacter), серрациа (Serratia).
3.2 бактерии рода Campylobacter: Грамотрицательные, неспорообразующие, микроаэрофильные, оксидазоположительные, подвижные мелкие бактерии спиралевидной S-образной или изогнутой формы.
Примечание — При культивировании более 48 — 72 ч образуют кокковые формы. Углеводы не ферментируют и не окисляют. Для человека наиболее опасен С. jejuni.
3.3 бактерии рода Proteus: Грамотрицательные палочки, обладающие свойством ползучего роста, оксидазоотрицательные, образующие сероводород и дезаминирующие фенилаланин.
3.4 бактерии рода Pseudomonas: Грамотрицательные, подвижные, прямые или слегка изогнутые палочковидные бактерии, оксидазоположительные, аэробы, окисляющие глюкозу.
3.5 бактерии рода Salmonella: Грамотрицательные, подвижные (кроме S. pullorum, S. gallinarum) палочки с закругленными концами, оксидазоотрицательные, каталазоположительные, ферментирующие глюкозу с образованием кислоты и газа, не ферментирующие лактозу (кроме S. typhi), в основном образующие сероводород, не гидролизующие мочевину, не образующие ацетоин, индол и р-галактозидазу (кроме S. arizona), образующие L-лизиндекарбоксилазу (кроме Salmonella paratiphi А).
3.6 дрожжи: Грамположительные, неподвижные, овальной или эллипсовидной формы клетки; факультативные анаэробы, размножающиеся почкованием или спорообразованием.
3.7 запас рабочей культуры: Культура эталонного штамма в условиях временного хранения (полужидкий агар, 4 °С — 8 °С).
3
3.8 запас эталонной культуры: Культура эталонного штамма в условиях длительного хранения (жидкий азот, минус 70 °С).
3.9 импеданс Z: Сопротивление потоку переменного тока через проводящий материал; является функцией активной проводимости, емкостного сопротивления и применяемой частоты, измеряемых в омах по формуле
где R —активное омическое сопротивление, Ом;
F —частота, Гц;
С —емкостная составляющая, пФ.
3.10 коагулазоположительные стафилококки: Грамположительные, каталазоположительные микроорганизмы, которые образуют типичные и/или атипичные колонии на/или в селективно-диагностической питательной среде, дающие положительную реакцию на коагулазу или специфическую для кроличьей плазмы реакцию на агаре с кроличьей плазмой и фибриногеном.
3.11 культура для целевого использования: Культура эталонного штамма, прошедшая не более двух пассажей после высева со среды временного хранения (из запасов рабочей культуры), предназначенная для использования в исследованиях.
3.12
культуральная среда: Перечень ингредиентов в жидкой, полужидкой или твердой формах, которые содержат натуральные и/или синтетические компоненты, для того чтобы поддерживать размножение или сохранять жизнеспособность микроорганизмов.
[ГОСТ Р ИС011133-1—2008, статья 3.3.1]
3.13 лиофилизированная культура: Культура, высушенная при низких температурах в вакууме.
3.14 молочнокислые микроорганизмы: Грамположительные, микроаэрофильные, неподвижные, неспорообразующие палочки, иногда кокковидной формы, или кокки, каталазоотрицательные, сбраживающие углеводы с образованием молочной кислоты.
3.15 непрямой метод (косвенный) измерения импеданса: Метод регистрации изменения импеданса посредством определения количества диоксида углерода (С02), образуемого в ходе процесса обмена веществ микроорганизмов.
3.16 плесневые грибы: Гифомицеты, поскольку тело плесневых грибов состоит из тонких ветвящихся нитей — гифов.
3.17 прямой метод измерения импеданса: Метод определения изменения импеданса питательной среды, обусловленного разложением питательных субстратов в процессе метаболизма микроорганизмов.
3.18 скрининг (от англ, screening «просеивание»): Общее название метода проверок больших групп объектов, обследований с целью выявления возбудителей заболеваний для проведения профилактических мероприятий.
3.19 сульфитредуцирующие кпостридии: Грамположительные, спорообразующие, сульфитреду-цирующие, каталазоотрицательные палочки, способные расти в анаэробных условиях.
3.20 тест-штаммы микроорганизмов: Микроорганизмы, типичные по культуральным, морфологическим и биохимическим свойствам, паспортизированные в установленном порядке.
3.21 основные методы микробиологических исследований: Методы классического анализа, лежащие в основе утвержденных установленным порядком микробиологических исследований.
3.22 ускоренные методы микробиологических исследований: Методы микробиологических исследований, позволяющие в более короткий промежуток времени, по сравнению с основными методами, получить результаты испытаний.
3.23 энтерококки: Грамположительные кокки овальной или круглой формы; располагаются парами, короткими или длинными цепочками; факультативные анаэробы, оптимальная температура роста 37 °С, каталазоотрицательные разлагают глюкозу и маннит с образованием кислоты и газа.
3.24 эталонный штамм (референтный штамм, референс-штамм): Микроорганизм, определенный, по меньшей мере, до рода и вида, включенный в каталог и описанный в соответствии с его характеристиками.
3.25 Bacillus cereus: Грамположительные, каталазоположительные, спорообразующие, подвижные палочки, ферментирующие в анаэробных условиях глюкозу, нитратредуцирующие, образующие ацетилме-тилкарбинол и не ферментирующие маннит.
3.26 Escherichia coli: Грамотрицательные, оксидазоотрицательные бактерии, ферментирующие лактозу при температуре (44 ± 1) °С с образованием газа и образующие индол из триптофана, не образующие ацетоин и не утилизирующие цитрат, дающие положительную реакцию с метил-рот, ферментирующие глюкозу и сорбит.
3.27 Listeria monocytogenes: Грамположительные, неспорообразующие, тонкие, короткие палочки, подвижные при температуре (22 ± 1) °С и неподвижные или слабоподвижные при температуре (37 ± 1) °С, каталозоположительные, оксидазоотрицательные, гидролизующие эскулин, ферментирующие с образованием кислоты рамнозу и маннозу, не ферментирующие маннит и ксилозу, обладающие р-гемолитической и лецитиназной активностью (лецитиназная активность только в присутствии активированного угля).
3.28 Staphylococcus aureus: Коагулазоположительные стафилококки, образующие ацетоин, ферментирующие мальтозу в аэробных условиях.
3.29 Yersinia enterocolitica: Грамотрицательные, полиморфные палочки, подвижные при температуре 22 °С—29 °С; факультативные анаэробы, каталазоположительные, оксидазоотрицательные, ферментирующие большинство углеводов (исключая лактозу и рамнозу) без образования газа.
4 Средства измерений, аппаратура, лабораторная посуда, материалы и реактивы
4.1 Средства измерений, аппаратура, лабораторная посуда, материалы и реактивы для основных методов анализа
Средства измерений, аппаратура, лабораторная посуда, материалы и реактивы — по ГОСТ Р ИСО 7218, ГОСТ 10444.1, ГОСТ 25336 со следующими дополнениями.
Анаэробные сосуды с оборудованием для генерирования анаэробной атмосферы, включая систему для проверки анаэробных условий.
Бидистиллятор.
Весы лабораторные общего назначения с наибольшим пределом взвешивания 200 г (для взвешивания реактивов) с пределом допускаемой абсолютной погрешности однократного взвешивания не более ± 0,01 мг.
Весы лабораторные общего назначения с наибольшим пределом взвешивания 1 кг (для взвешивания продукта) с пределом допускаемой абсолютной погрешности однократного взвешивания не более ± 20,0 мг.
Баня водяная с терморегулятором по ГОСТ Р ИСО 7218 для поддержания заданной температуры с погрешностью ± 0,5 °С, кроме особо оговоренных случаев.
Генератор анаэробной атмосферы.
Генератор микроаэрофильной атмосферы.
Гомогенизатор типа мастикатор или другие модели.
Дилютер гравиметрический — автоматизированная система для разведения образцов.
Дистиллятор, обеспечивающий качество дистиллированной воды в соответствии с ГОСТ 6709.
Дозаторы переменного объема.
Дозаторы пипеточные.
Дозаторы для розлива питательных сред.
Лампа ультрафиолетовая с длиной волны 254 нм (лампа ртутная низкого давления).
Примечание — При работе с ультрафиолетовой лампой используют защитные очки и перчатки для предупреждения раздражения глаз и кожи.
Лупа.
Микроскоп биологический, обеспечивающий просмотр в проходящем свете, с увеличением 900х — 1000х с иммерсионнной системой или с приспособлением для фазовоконтрастного микроскопи-рования.
Шкаф морозильный.
Прибор нагревательный для варки питательных сред либо магнитные мешалки с подогревом.
Насадки к дозаторам.
Облучатель бактерицидный настенный ОБН-150.
Поплавки для пробирок.
Машина посудомоечная.
5
Прибор для подсчета колоний микроорганизмов.
Ридер (иммуноферментный анализатор).
Ротатор 40 — 42 об/мин стаймером.
pH-метр, обеспечивающий измерение с допускаемой погрешностью ± 0,1.
СВЧ-печь (для расплавления питательных сред).
Система для анаэробного культивирования с манометром (анаэростат).
Примечание — Материалы и лабораторная посуда, поставляемые нестерильными, стерилизуют в соответствии с установленными процедурами.
Стерилизатор суховоздушный.
Стерилизатор паровой медицинский по ГОСТ Р 51935.
Термометр ртутный по ГОСТ 13646 с диапазоном измерения от 0 °С до 220 °С (цена деления шкалы 1 °С).
Термостаты, обеспечивающие поддержание температуры в интервале (24 ± 0,5) °С — (60 ± 0,5) °С. Холодильник бытовой электрический по ГОСТ 16317 с морозильной камерой.
Центрифуга универсальная лабораторная (20000 хд) с охлаждением.
Часы механические сигнальные по ГОСТ 3145.
Тара стеклянная для химических реактивов и особо чистых веществ по ГОСТ Р 51477.
Воронки из полимерных материалов, металлические.
Кастрюли эмалированные по ГОСТ24788.
Колбы плоскодонные конические или круглые разной вместимости по ГОСТ 1770.
Колбы мерные наливные вместимостью 500 и 1000 см3.
Контейнеры для анаэробного культивирования.
Микротест системы для биохимической идентификации энтеробактерий (МТС-М-12Е).
Микротест системы для биохимической идентификации стафилококков (МТС-С).
Микротест системы для биохимической идентификации сальмонелл (МТС-Сальм).
Пипетки полимерные стерильные для однократного применения.
Посуда мерная лабораторная стеклянная по ГОСТ 1770: цилиндры (вместимостью 100; 250; 500 см3), мензурки, колбы, пробирки (вместимостью 10; 15; 20 см3).
Посуда лабораторная стеклянная.
Пипетки градуированные по ГОСТ 29227.
Пробирки (многоразового или одноразового пользования) по ГОСТ 25336.
Флакон-дозатор для дозирования жидкостей.
Флаконы с резьбой и крышкой стерилизуемые (500 — 1000 см3).
Чашки Петри среднего размера (диаметр 90 или 100 мм) и/или большие (диаметр 140 мм).
Биотест для контроля тепловой стерилизации.
Биотест для контроля «холодной» стерилизации.
Бумага фильтровальная лабораторная по ГОСТ 12026.
Вата медицинская гигроскопическая по ГОСТ 5556.
Горелки газовые.
Дезодорант для автоклавирования отработанного материала.
Диски индикаторные с реактивами для идентификации микроорганизмов.
Диски с бацитрацином для идентификации стрептококков.
Зажимы для пакетов.
Индикаторы анаэробной атмосферы.
Коробка для создания анаэробной атмосферы.
Красители для окрашивания капсул.
Красители для окрашивания по Граму.
Красители для окрашивания спор.
Маркеры по стеклу.
Марля медицинская по ГОСТ 9412.
Мешки полимерные для стерилизации и деструкции лабораторных принадлежностей.
Ножницы медицинские по ГОСТ 21239.
Пакеты газонепроницаемые стерильные для измельчения проб.
Пакеты газонепроницаемые стерильные различного объема для контейнеров анаэростатов, хранения и инкубации посевов в чашках Петри.
6
ГОСТ P 54354—2011
Палочки стеклянные по ГОСТ 21400.
Перчатки пластиковые, резиновые.
Петля бактериологическая платино-иридиевая или никель-хромовая диаметром около 3 мм.
Петля бактериологическая полимерная объемом 1; 10 мкп.
Пинцет медицинский по ГОСТ 21241.
Пипетки пастеровские — стеклянные и пластиковые.
Пипетки по ГОСТ 29227 вместимостью 1,0; 2,0; 5,0; 10,0 см3 с ценой деления 0,01; 0,02; 0,05; 0,1 см3 соответственно.
Подставки для пакетов.
Полоски индикаторные.
Полоски с реактивом Ковача (на индол).
Полоски с ацетатом свинца (на сероводород).
Пробки и колпачки для пробирок (силиконовые, резиновые, металлические и другие), выдерживающие стерилизацию сухим жаром или автоклавированием.
Система для быстрой идентификации энтеробактерий по биохимическим признакам.
Скальпель хирургический по ГОСТ 21240.
Слайды или планшеты для иммунологических реакций.
Смесь газов 02 — 5 %, С02 — 10 %, N2 — 95 % — в баллоне.
Спиртовки лабораторные.
Спиртовки лабораторные стеклянные по ГОСТ23932.
Стандарт мутности Макфарланда по [1].
Стандартный образец мутности по [2].
Стационарный С02 — инкубатор.
Стекла предметные для микропрепаратов по ГОСТ 9284.
Стекла покровные для микропрепаратов по ГОСТ 6672.
Тампоны стерильные в индивидуальной упаковке для отбора проб с поверхностей производственных объектов методом смыва.
Термоконтейнер (сумка-холодильник).
Шпатели бактериологические.
Штативы для пробирок.
Электроплитка по ГОСТ 14919.
Ацетон по ГОСТ 2603.
Бриллиантовый зеленый.
Бромкрезол пурпурный.
Бромтимоловый синий.
Ванкомицин для выявления бактерий рода Leuconostoc.
Вода дистиллированная по ГОСТ 6709.
Гептадецилсульфат натрия (тергитол).
Гидрохлорид.
2,3,5-трифенилтетразолиум хлорид (ТТХ).
DL-тригттофан.
Железо (II) сернокислое по ГОСТ 4148.
Желчь бычья сухая или натуральная.
Йод кристаллический.
Калий йодистый.
Р-диметиламин бензальдегид.
Калия гидроокись по ГОСТ 24363.
Кислота 5-амино-2-нафтален сульфоновая.
Кислота соляная по ГОСТ 3118.
Кислота сульфаниловая.
Креатин.
Кристаллический фиолетовый.
Лактоза по ГОСТ 6038.
L-тригттофан.
Оксалат малахитовый зеленый.
Масло иммерсионное для микроскопии по ГОСТ 13739.
7