ГОСТ Р ИСО 10993-11-2009
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 11. Исследования общетоксического действия
Устанавливает требования и дает рекомендации по процедурам, необходимым для оценки потенциального общетоксического действия химических компонентов, мигрирующих в организм из медицинских изделий. Стандарт распространяется на оценку конечного продукта и компонентов его вымывания. Исследования экстрактов из изделия или продуктов вымывания следует проводить с использованием модельной среды, которая обеспечивает максимальную экстракцию продуктов вымывания для дальнейшего биологического исследования.
- Заменяет ГОСТ Р ИСО 10993.11-99 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 11. Исследование общетоксического действия» ИУС 1-2010
Идентичен ISO 10993-11:2006
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Основные требования
4.1 Общие положения
4.2 Выбор вида животных
4.3 Статус животных
4.4 Уход и содержание животных
4.5 Размер и число групп
4.6 Путь введения
4.7 Подготовка образца
4.8 Дозирование
4.9 Масса тела и потребление пищи/воды
4.10 Клинические наблюдения
4.11 Клиническая патология
4.12 Патологоанатомические исследования
4.13 Планирование исследований
4.14 Качество исследований
5 Острая системная токсичность
5.1 Общие положения
5.2 Планирование исследования
5.3 Критерии оценки
5.4 Заключительный отчет
6 Системная токсичность многократного введения (подострая, субхроническая и хроническая системная токсичность).................................................9
6.1 Общие положения
6.2 Планирование исследования
6.3 Критерии оценки
6.4 Заключительный отчет
Приложение А (справочное) Пути введения
Приложение В (справочное) Объемы дозирования
Приложение С (справочное) Распространенные клинические признаки и наблюдения
Приложение D (справочное) Рекомендуемые параметры гематологии, клинической химии и анализа мочи
Приложение Е (справочное) Список рекомендуемых органов для гистопатологической оценки
Приложение F (справочное) Информация по пирогенам, опосредованным материалом
Приложение G (справочное) Сведения о соответствии национальных стандартов Российской Федерации ссылочным международным стандартам
Библиография
27 страниц
| Дата введения | 01.09.2010 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Завершение срока действия | 01.01.2013 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
Организации:
| 20.10.2009 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 460-ст |
|---|---|---|---|
| Разработан | АНО ИМБИИТ | ||
| Издан | Стандартинформ | 2010 г. |
Medical devices. Biological evaluation of medical devices. Part 11. Tests for systemic toxicity
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19
стр. 20
стр. 21

стр. 22

стр. 23

стр. 24
стр. 25

стр. 26

стр. 27
ГОСТ Р исо
10993-11-
2009
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
НАЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
ИЗДЕЛИЯ МЕДИЦИНСКИЕОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 11
Исследования общетоксического действия
ISO 10993-11:2006
Biological evaluation of medical devices — Part 11: Tests for systemic toxicity
(ITD)
Издание официальное
Москва
Стандартинформ
2010
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании», а правила применения национальных стандартов Российской Федерации — ГОСТ Р 1.0-2004 «Стандартизация в Российской Федерации. Основные положения»
Сведения о стандарте
1 ПОДГОТОВЛЕН Автономной некоммерческой организацией «Институт медико-биологических исследований и технологий (АНО «ИМБИИТ»)
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 422 «Оценка биологического действия медицинских изделий»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 20 октября 2009 г. Ne 460-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 10993-11:2006 «Оценка биологического действия медицинских изделий. Часть 11. Исследования общетоксического действия» (ISO 10993-11:2006 «Biological evaluation of medical devices — Part 11: Tests for systemic toxicity»).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации, сведения о которых приведены в дополнительном приложении G
5 ВЗАМЕН ГОСТ Р ИСО 10993.11-99
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе «Национальные стандарты», а текст изменений и поправок — в ежемесячно издаваемых информационных указателях «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
© Стандартинформ.2010
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
II
Содержание
1 Область применения...................................................1
2 Нормативные ссылки..................................................1
3 Термины и определения................................................1
4 Основные требования..................................................2
4.1 Общие положения..................................................2
4.2 Выбор вида животных...............................................2
4.3 Статус животных...................................................3
4.4 Уход и содержание животных...........................................3
4.5 Размер и число групп................................................3
4.6 Путь введения....................................................4
4.7 Подготовка образца.................................................4
4.8 Дозирование.....................................................4
4.9 Масса тела и потребление пищи/воды.....................................5
4.10 Клинические наблюдения............................................5
4.11 Клиническая патология..............................................5
4.12 Патологоанатомические исследования...................................5
4.13 Планирование исследований..........................................6
4.14 Качество исследований.............................................6
5 Острая системная токсичность............................................6
5.1 Общие положения..................................................6
5.2 Планирование исследования...........................................6
5.3 Критерии оценки...................................................8
5.4 Заключительный отчет...............................................8
6 Системная токсичность многократного введения (подострая, субхроническая и хроническая
системная токсичность).................................................9
6.1 Общие положения..................................................9
6.2 Планирование исследования..........................................10
6.3 Критерии оценки..................................................11
6.4 Заключительный отчет..............................................12
Приложение А (справочное) Пути введения.....................................13
Приложение В (справочное) Объемы дозирования................................15
Приложение С (справочное) Распространенные клинические признаки и наблюдения..........16
Приложение D (справочное) Рекомендуемые параметры гематологии, клинической химии и
анализа мочи..............................................17
Приложение Е (справочное) Список рекомендуемых органов для гистопатологической оценки .... 18
Приложение F (справочное) Информация по пирогенам, опосредованным материалом........19
Приложение G (справочное) Сведения о соответствии национальных стандартов Российской
Федерации ссылочным международным стандартам.....................20
Библиография........................................................21
III
Введение
Соблюдение положений стандартов серии ИСО 10993 «Оценка биологического действия медицинских изделий» позволит обеспечить системный подход к исследованию биологического действия медицинских изделий.
Целью этих стандартов не является безусловное закрепление единообразных методов исследований и испытаний за группами однородных медицинских изделий в соответствии с принятой классификацией их по виду и длительности контакта с организмом человека. Поэтому планирование и проведение исследований и испытаний должны осуществлять специалисты, имеющие соответствующую подготовку и опыт в области санитарно-химической, токсикологической и биологической оценок медицинских изделий.
Стандарты серии ИС0 10993 являются руководящими документами для прогнозирования и исследования биологического действия медицинских изделий на стадии выбора материалов, предназначенных для их изготовления, а также для исследований готовых изделий.
В серию ИСО 10993 входят следующие части под общим названием «Оценка биологического действия медицинских изделий»:
Часть 1—Оценка и исследования:
Часть 2 — Требования к обращению с животными;
Часть 3 — Исследования генотоксичности. канцерогенности и токсического действия на репродуктивную функцию;
Часть 4 — Исследование изделий, взаимодействующих с кровью;
Часть 5 — Исследование на цитотоксичность: методы in vitro;
Часть 6 — Исследование местного действия после имплантации;
Часть 7 — Остаточное содержание этиленоксида после стерилизации;
Часть 9 — Основные принципы идентификации и количественного определения потенциальных продуктов деградации;
Часть 10 — Исследование раздражающего и сенсибилизирующего действия;
Часть 11 —Исследование обще токсического действия;
Часть 12 — Приготовление проб и стандартные образцы;
Часть 13 — Идентификация и количественное определение продуктов деградации полимерных медицинских изделий;
Часть 14 — Идентификация и количественное определение продуктов деградации изделий из керамики;
Часть 15 — Идентификация и количественное определение продуктов деградации изделий из металлов и сплавов;
Часть 16 — Моделирование и исследование токсикокинетики продуктов деградации и вымывания;
Часть 17 — Установление пороговых значений для вымываемых веществ;
Часть 18 — Исследование химических свойств материалов;
Часть 19 — Исследование физико-химических, морфологических и топографических свойств материалов;
Часть 20 — Принципы и методы исследования иммунотоксического действия медицинских изделий.
Системная токсичность является потенциальным неблагоприятным эффектом использования медицинских изделий. Эффекты обобщенного характера, а также конкретных органов и систем могут появляться в результате абсорбции, распределения и метаболизма веществ, вымываемых из изделия или его материалов, в участках организма, с которыми они не находятся в прямом (непосредственном) контакте. Настоящий стандарт рассматривает оценку обобщенной системной токсичности, но не токсичности конкретного органа-мишени или системы органов, несмотря на то. что таковая может развиться в результате систематической абсорбции и распределения токсических веществ.
В связи с широким спектром медицинских изделий, их материалов и предназначенного использования настоящий стандарт не является строгим предписанием. Несмотря на то, что он рассматривает конкретные методологические аспекты, которые нужно учитывать при планировании исследований системной токсичности, приемлемый план исследований должен быть выработан отдельно с учетом характеристик материалов изделия и его предполагаемого клинического применения.
Другие элементы настоящего стандарта носят нормативный характер, включая аспекты соответствия нормам надлежащей лабораторной практики и сведения, отражаемые в отчетности.
IV
Несмотря на то. что некоторые исследования системной токсичности (например, долгосрочная имплантация или исследования кожной токсичности) могут быть рассчитаны на изучение как системных, так и местных, канцерогенных или репродуктивных эффектов, настоящий стандарт концентрируется только на аспектах таких исследований, предназначенных для оценки системных эффектов. Исследования. предназначенные для оценки других токсикологических конечных точек, рассматриваются в ИС010993-3. ИСО 10993-6. ИСО 10993-10 и ИСО 10993-20.
Пирогенность (см. приложение F) представляет собой дополнительный системный эффект, который исторически рассматривается в настоящем стандарте. Тем не менее, предпринимаются шаги для создания отдельного стандарта, посвященного пирогенности.
Токсикология не является точной наукой. Результат любого отдельного анализа не должен становиться единственным основанием определения безопасности изделия при его предназначенном применении.
V
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИЗДЕЛИЯ МЕДИЦИНСКИЕ ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 11
Исследования общетоксического действия
Medical devices. Biological evaluation of medical devices.
Part 11. Tests for systemic toxicity
Дата введения — 2010—09—01
1 Область применения
Настоящий стандарт устанавливает требования и дает рекомендации по процедурам, необходимым для оценки потенциального общетоксического действия химических компонентов, мигрирующих в организм из медицинских изделий.
Настоящий стандарт распространяется на оценку конечного продукта и компонентов его вымывания. Исследования экстрактов из изделия или продуктов вымывания следует проводить с использованием модельной среды, которая обеспечивает максимальную экстракцию продуктов вымывания для дальнейшего биологического исследования.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ИСО 10993-1 Оценка биологического действия медицинских изделий. Оценка и исследования
ИСО 10993-2 Оценка биологического действия медицинских изделий. Часть 2. Требования к обращению с животными
ИСО 10993-12 Оценка биологического действия медицинских изделий. Часть 12. Приготовление проб и стандартные образцы
3 Термины и определения
В настоящем стандарте применены термины по ИСО 10993-1. а также следующие термины с соответствующими определениями:
3.1 доза: Количество вводимой исследуемой пробы (т. е. масса, объем), выражаемое на единицу массы тела или площади поверхности.
3.2 доза—эффект: Взаимоотношение между дозировкой и масштабами определенного биологического эффекта в организме отдельной особи или в выборке группы.
3.3 доза — ответ: Взаимоотношение между дозировкой и спектром эффектов, связанных с воздействием.
Примечание — Существует два типа отношений доза — ответ. Первым типом является реакция особи на диапазон доз. Вторым типом является распределение реакций труппы особей на диапазон доз.
3.4 вымываемое вещество: Химическое вещество, удаляемое из изделия или материала посредством воды или других жидкостей, связанных с применением изделия.
Издание официальное
Примечание — Примерами вымываемых веществ являются добавки, остатки стерилизующего агента, остатки продуктов обработки, продукты деградации, растворители, пластификаторы, смазочные вещества, катализаторы. стабилизаторы, антиоксиданты, красители, наполнители и мономеры.
3.5 определяющая доза: Применение одной группы, получающей соответствующую дозу испытуемого образца для определения наличия или отсутствия токсической опасности.
3.6 хроническая системная токсичность: Неблагоприятный эффект, возникающий после многократного или постоянного введения исследуемой пробы в течение большей части продолжительности жизни.
Примечание — Исследования хронической токсичности обычно длятся от 6 до 12 мес.
3.7 острая системная токсичность: Неблагоприятный эффект, возникающий в любое время после введения однократной или многократных доз исследуемой пробы в течение 24 ч.
3.8 подострая системная токсичность: Неблагоприятный эффект, возникающий после ежедневного введения однократной или многократных доз исследуемой пробы в период от 24 ч до 28 сут.
Примечание — Неблагоприятный эффект, возникающий в указанный период времени, может также быть описан как исследование системной токсичности краткосрочного повторяющегося введения. Выбор интервалов времени от 14 до 28 сут соответствует требованиям большинства международных нормативных руководств и считается разумным подходом. Исследования подострой токсичности при внутривенных введениях проводятся в период более 24 ч. но менее 14 сут.
3.9 субхроническая системная токсичность: Неблагоприятный эффект, возникающий после ежедневного введения однократной или многократных доз исследуемой пробы в течение части общей продолжительности жизни (обычно 90 сут, но не более 10 % продолжительности жизни).
Примечание — Исследования субхронической токсичности обычно длятся 90 сут для грызунов, но не превышают 10 % продолжительности жизни у животных других видов.
3.10 хроническая системная токсичность: Неблагоприятный эффект, возникающий после повторного или постоянного введения исследуемой пробы в течение большей части продолжительности жизни.
Примечание — Исследования хронической токсичности обычно длятся от 6 до 12 мес.
3.11 исследуемый образец: Материал, изделие, часть изделия, компонент, экстракт или его порция, подвергаемые биологическому или химическому тестированию или оценке.
4 Основные требования
4.1 Общие положения
Выбор приемлемого исследования или исследований изделия проводится в соответствии с ИС010993-1, учитывая характер и длительность контакта. Исследование проводят на конечном продукте и/или представительных образцах компонентов готового изделия и/или материалов. Исследуемые образцы должны отражать условия обычного производства и обработки изделия. Если отклонения необходимы, они должны быть отмечены в отчете исследования вместе с их обоснованием. В целях определения опасности может быть необходимо преувеличение введения исследуемых образцов.
При планировании исследования необходимо рассмотреть такие факторы. как физические и химические свойства испытуемого образца, включая, например. pH. стабильность, вязкость, осмоляльность, буферные качества, растворимость и стерильность.
При рассмотрении исследований на животных необходимо определить и внедрить все разумно и практически доступные альтернативы замены, сокращения и усовершенствования для соответствия положениям ИС0 10993-2. Для исследования острой токсичности in vivo данные цитотоксичности in vitro полезны для определения начальных доз (9).
4.2 Выбор вида животных
Не существует абсолютного критерия выбора определенного вида животных для исследования системной (общей) токсичности медицинских изделий. Тем не менее, выбор используемых видов должен быть научно обоснован и соответствовать положениям ИСО 10993-2. Мыши или крысы предпочтительны для острых оральных, внутривенных, дермальных и ингаляционных исследований медицинских изделий: кролики являются вариантом при дермальных и имплантационных исследованиях. Виды, не относящиеся к грызунам, также могут применяться для исследования с учетом того, что ряд факторов может повлиять на число особей для исследования.
2
Предпочтительно использование животных одного вида при проведении серии исследований системной токсичности различной длительности, например, острой, подострой, субхронической и/или хронической системной токсичности. Такой подход контролирует внутривидовую изменчивость и способствует оценке исключительно по длительности исследования. При использовании животных разных видов необходимо отразить документально обоснование их выбора.
4.3 Статус животных
Как правило, необходимо использовать здоровых, специально выведенных, молодых половозрелых животных известного происхождения, не инфицированных. В начале исследования вариантность массы используемых животных для каждого пола не должна превышать г 20 % средней массы. Используемые самки должны быть не рожавшими и не беременными. Выбор животных должен быть обоснован.
4.4 Уход и содержание животных
Уход и обращение с животными должны соответствовать принятым руководствам по содержанию животных. Необходимо акклиматизировать животных к условиям лаборатории до обработки и зафиксировать этот период времени документально. Контроль условий окружающей среды и методов надлежащего ухода за животными необходим для получения значимых результатов. Необходимо должным образом охарактеризовать составляющие диеты и подстилок, о которых известно, что они вырабатывают или влияют на токсичность, а также учитывать их потенциальное влияние на результаты исследования.
4.5 Размер и число групп
4.5.1 Размер групп
Точность исследования системной токсичности зависит в большой степени от числа используемых животных на уровень дозы. Степень необходимой точности и. в свою очередь, необходимое число животных на группу дозирования зависят от цели исследования.
Число животных в группе должно логически увеличиваться при увеличении длительности эксперимента, так что к концу исследования в каждой группе должно присутствовать достаточное число животных для тщательной биологической оценки. Тем не менее, необходимо использовать минимальное число животных, требуемое для получения значимых результатов (см. ИСО 10993-2). Рекомендуемые минимальные размеры групп, учитывая виды исследования, приведены в таблице 1.
|
Таблица 1 — Рекомендуемые минимальные размеры групп | ||||||||||||||||||
| ||||||||||||||||||
4.5.2 Число групп
Группа одной дозы, получающая приемлемую дозировку испытуемого образца, в рамках одного вида может обозначить наличие или отсутствие токсической опасности (т. е. отношение доза — ответ). Тем не менее, для определения токсического ответа в других многодозовых исследованиях или исследованиях дозового ответа требуется несколько групп.
Число групп может увеличиваться при увеличении дозы. Необходимо учитывать следующие примеры увеличенной дозы:
- многократное воздействие на площадь клинической поверхности;
- многократная длительность введения;
- многократная доля экстракта или отдельных химических веществ;
- многократные введения в течение 24 ч.
3
Могут быть допустимы другие методы увеличения дозы. Используемый метод должен быть обоснован.
4.5.3 Группы контроля
В зависимости от цели исследования, характера предмета исследования и пути введения при исследовании системной токсичности необходимы: отрицательный контроль, контроль модельной среды, наполнителя, доставки и/или необработанный (ложный) контроль. Эти методы контроля должны использовать идентичные подготовку испытуемого образца и процедуру введения.
4.6 Путь введения
Медицинские изделия или их вымываемые вещества могут различно воздействовать на организм. Исследуемый путь введения изделия в организм, по возможности, должен быть наиболее приближен к использованию в клинической практике. Если необходим альтернативный путь введения, он должен быть обоснован. Примеры путей введения приведены в приложении А.
4.7 Подготовка образца
Руководство по подготовке образца и стабильности приведено в ИСО 10993-12.
4.8 Дозирование
4.8.1 Введение исследуемого образца
Процедуры введения следует проводить с учетом физиологических особенностей, избегая нанесения ущерба здоровью животных, не связанных напрямую с токсичностью исследуемого материала. Если ежедневно вводимая доза или концентрация превышает возможности введения, дозу можно вводить меньшими долями в период, не превышающий 24 ч.
Исследуемые образцы следует вводить при физиологически приемлемой температуре. В общей практике, как правило, применяется комнатная температура или температура тела. Отклонения должны быть обоснованы.
Наполнители, вводимые парэнтерально, должны быть физиологически совместимыми. При необходимости можно использовать фильтрацию образца для удаления частиц и отразить это документально.
Механическое ограничение движения животных при повторном воздействии в исследованиях системной токсичности должно, как правило, ограничиваться 4—6 ч в сут. Характер и длительность двигательного ограничения животных должны быть минимально требуемыми для достижения научных целей и не должны сами по себе наносить ущерб здоровью исследуемых животных. Отклонения должны быть обоснованы.
Если двигательное ограничение необходимо, животные должны быть акклиматизированы к ограничивающему устройству до введения исследуемого образца.
4.8.2 Объемы дозирования
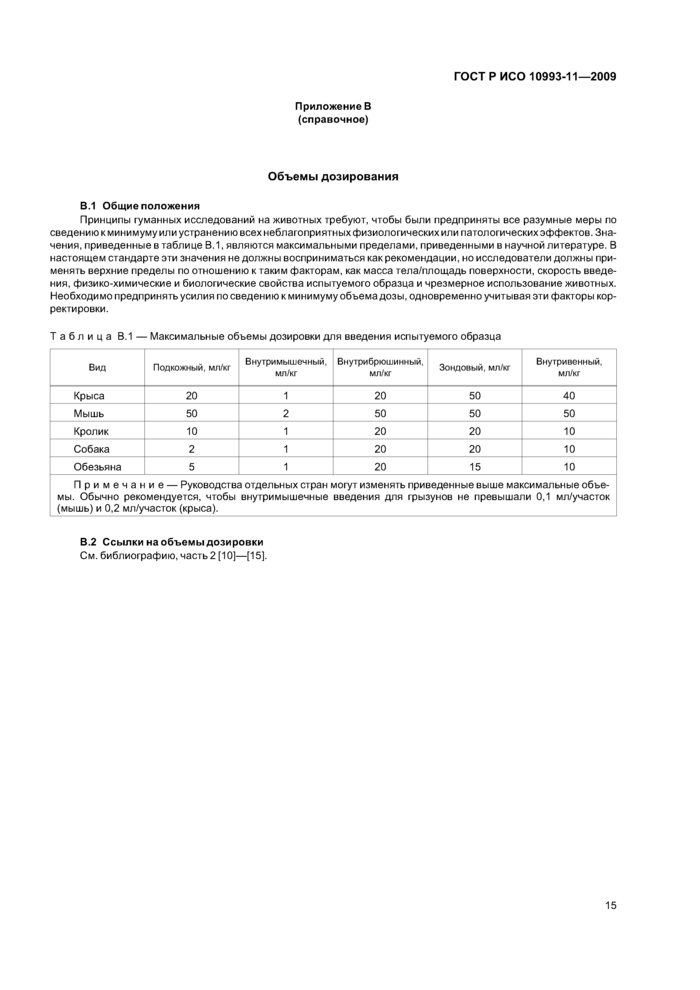
Руководство по объему дозирования приведено в приложении В. При использовании нескольких дозовых групп вариантность исследуемого объема может быть сведена до минимума путем регулирования концентрации для обеспечения постоянного объема при всех дозах. Использование объемов дозирования. превышающих приведенные в приложении В. должно быть обосновано.
Необходимо избегать введения оральным путем доз больших объемов, так как было показано, что они перегружают вместимость желудка и немедленно поступают в тонкий кишечник. Дозы больших объемов могут вернуться в пищевод.
Внутримышечное введение также ограничено по объему в зависимости от размеров животного и расположения мышцы. Объемы внутримышечного введения по видам рассмотрены в приложении В.
Болюсное внутривенное вливание обычно вводят за короткий период времени течением примерно за 1 мин. Скорость инъекции является важным фактором, и рекомендуется, чтобы для грызунов эта скорость не превышала 2 мл/мин.
Для введения большого объема может потребоваться медленная или рассчитанная по времени инъекция или внутривенная инфузия. Если животное подает признаки явного изменения клинического состояния, скорость введения жидкости должна быть остановлена или снижена вне зависимости от рассчитанной скорости.
Для исследуемых образцов, ограниченных растворимостью или раздражающим действием, может быть необходима медленная внутривенная инъекция.
При клинических показаниях можно использовать продолжительную/постоянную инфузию. Объем и скорость введения будут зависеть от вводимого вещества, принимая во внимание стандартную практику жидкостной терапии. В качестве руководства единовременно вводимый объем должен составлять менее 10 % объема циркулирующей крови за 2 ч. При длительной инфузии ключевым фактором к рассмотрению является минимально эффективное двигательное ограничение исследуемых животных.
4
Объемы дозирования при подкожном введении приведены в приложении В. Скорость и степень абсорбции зависят от состава испытуемого образца.
4.8.3 Частота дозирования
Частота дозирования должна основываться на клинической значимости. Увеличение числа процедур должно быть четко обосновано и описано.
При исследованиях острой системной токсичности животных подвергают воздействию однократной дозы или ее многократными долями, вводимыми в течение 24 ч.
При исследованиях многократного введения животные должны получать исследуемую дозу ежедневно. в течение недели, всю продолжительность исследования. Другие режимы дозирования могут быть приемлемы, но должны быть обоснованы.
4.9 Масса тела и потребление пищиУводы
Исследуемый объект может вызвать изменения в массе тела животного и в потреблении им пищи и воды. Следовательно, необходимо определять индивидуальную массу каждого животного незадолго до введения испытуемого образца (например, обычно в пределах 24 ч при однократном или остром дозировании и не более чем 7 сут при исследованиях повторного введения), через регулярные интервалы в течение исследования и по окончании исследования. При дозировке по массе тела необходимо использовать самые последние измерения.
При более длительных исследованиях многократного введения должно быть определено количество потребляемой животным пищи и воды.
4.10 Клинические наблюдения
Клинические наблюдения должны проводить подготовленные лица для обеспечения последовательной отчетности. Частота и длительность наблюдения должны определяться характером и серьезностью токсических реакций, скоростью проявления симптомов и периода восстановления. Повышенная частота наблюдения может быть необходима на ранних стадиях исследования, особенно при острых исследованиях. Время появления и исчезновения признаков токсичности, их длительность и время смерти являются важными, особенно если неблагоприятные клинические признаки или смерть имеют тенденцию проявляться позднее. Во избежание ненужных страданий необходимо применять гуманные конечные точки. Общие клинические наблюдения должны учитывать пиковый период ожидаемых эффектов после дозирования.
Наблюдения должны систематически фиксироваться документально по мере их ведения. Отчетность должна быть проведена по каждому животному.
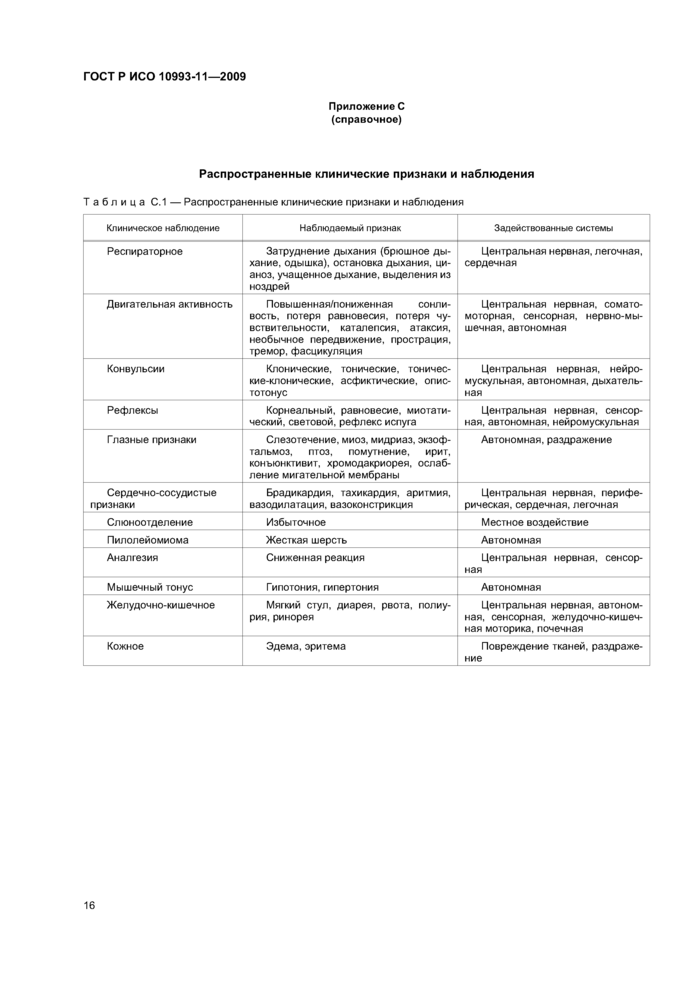
Визуальные наблюдения должны быть записаны. как минимум, один раз в день, с использованием общепринятых лабораторных признаков регистрации клинических эффектов (см. приложение С).
Наблюдаемая болезненность ил и смертность при повторном введении должна быть зафиксирована документально не менее двух раз в день. При более продолжительных исследованиях повторного введения может быть рассмотрен более обширный, как минимум, еженедельный скрининг токсических эффектов.
4.11 Клиническая патология
Для исследования токсических эффектов на тканях, органах и других системах проводят анализы гематологических и биохимических показателей. По показаниям эти анализы должны проводиться на пробах крови животных, используемых в исследовании повторного введения, полученных, по меньшей мере, непосредственно перед запланированной процедурой эфтаназии животных или как часть таковой процедуры. В некоторых случаях может быть необходимо голодание животных перед забором крови. Если существуют научные показания, в течение последней недели долгосрочного исследования при многократном введении может быть проведен анализ мочи с использованием рассчитанного по времени (например, от 16 до 24 ч) сбора объема мочи.
Рекомендуемые для оценки параметры гематологии, биохимии и анализа мочи приведены в приложении D.
4.12 Патологоанатомические исследования
По окончании исследований острой системной токсичности необходимо провести патологоанатомическую оценку.
Все животные должны быть подвергнуты вскрытию с полным и подробным макроскопическим обследованием, включающим тщательное обследование внешних покровов тела, всех отверстий, а также черепной, грудной и брюшной полостей и их содержимого. Органы, избранные для взвешивания, по возможности должны быть очищены от прилегающих тканей, и их масса во влажном состоянии должна быть измерена как можно быстрее во избежание высыхания.
В приложении Е приведен список тканей, которые необходимо взвесить и сохранить в приемлемой фиксирующей среде для патогистологического исследования.
5